题目内容
【题目】某小组利用 H2C2O4 溶液和酸性 KMnO4 溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4 溶液 | 酸性 KMnO4 溶液 | 温度℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后 H2C2O4 转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移__________mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为 n(H2C2O4)∶n(KMnO4)≥______________。
(2)探究温度对化学反应速率影响的实验编号是____________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得 KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________mol·L-1·min-1。
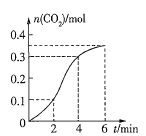
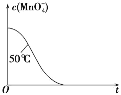
(4)已知50℃时c(MnO4-)~反应时间 t 的变化曲线如图。若保持其他条件不变,请在坐标图中,画出 25℃时c(MnO4-)~t的变化曲线示意图________。
(5)高锰酸钾和草酸反应开始速率较慢,反应一会儿,速率突然加快,合理的原因是_________
【答案】2 2.5 ②和③ ①和② 0.010 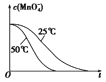
【解析】
(1)根据题中信息及化合价升降法配平反应的化学方程式,然后根据电子守恒计算出1mol草酸完全反应转移的电子数;根据“观察到紫色褪去”必须满足高锰酸钾的物质的量小于草酸的物质的量解得二者浓度关系;
(2)根据探究温度对反应速率影响时除了温度外其它条件必须相同判断;根据体积浓度对反应速率影响时除了浓度不同,其他条件必须完全相同分析;
(3)先根据草酸和高锰酸钾的物质的量判断过量,然后根据不足量及反应速率表达式计算出反应速率;
(4)根据温度降低反应速率减小画出25℃时c(MnO4-)~t的变化曲线图;
(5)从反应生成物的作用分析影响因素。
(1) 根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;H2C2O4中碳元素的化合价为+3价,变成二氧化碳后化合价总共升高了2×(4-3)价,所以每消耗1mol(H2C2O4)转移2mol电子;为了观察到紫色褪去,高锰酸钾的物质的量应该少量,即n(H2C2O4):n(KMnO4)≥5:2=2.5;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②;
(3)草酸的物质的量为:n(H2C2O4)=0.10molL-1×0.002L=0.0002mol,高锰酸钾的物质的量n(KMnO4)=0.010molL-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比n(H2C2O4):n(KMnO4)=0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度c(KMnO4)=![]() =
=![]() ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)=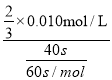 = 0.010mol/(Lmin);
= 0.010mol/(Lmin);
(4)由于在其他条件不变时,升高温度化学反应速率加快,降低温度,化学反应速率减小,则25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为: ;
;
(5) 高锰酸钾和草酸在溶液中发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,随着反应的进行,物质的浓度减小,反应速率不减小,反而是反应开始速率较慢,反应一会儿,速率突然加快,原因可能是反应产生了Mn2+,该离子对反应有催化作用,是化学反应速率大大加快。

【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
【题目】已知还原性:![]() 某无色溶液中只可能含有
某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分离子,进行下列实验:通过实验得出的结论正确的是
中的部分离子,进行下列实验:通过实验得出的结论正确的是![]()
实验编号 | 操作 | 现象 |
| 取10mL溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入过量的NaOH溶液并加热 | 产生448L气体 |
A.实验![]() 中若通入过量的
中若通入过量的![]() ,则先后氧化了
,则先后氧化了![]() 、
、![]()
B.上述3个实验不能确定是否一定含有![]() ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有
,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有![]()
C.判断溶液中是否含有钾离子,不需要通过焰色反应来检验
D.实验![]() 能够确定溶液中不含有
能够确定溶液中不含有![]()