题目内容
【题目】在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
COCl2(g) ΔH<0,已知容器Ⅰ中反应在5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | a | 0.55 | 0 | 0.5 |
Ⅲ | T | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.反应Ⅲ的温度T<500℃
C.容器Ⅱ中起始时CO的物质的量为1.0 mol
D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80%]
【答案】CD
【解析】
依据速率表达式计算用COCl2表示的反应速率,依据速率之比等于计量系数之比计算用CO表示速率;I和Ⅲ为等效平衡,依据温度改变后COCl2物质的量判断反应温度;依据Ⅰ组数据计算反应平衡常数,Ⅰ和Ⅱ温度相同则平衡常数相同,依据平衡常数计算容器Ⅱ中起始时CO的物质的量;根据勒夏特列原理分析平衡移动的方向,比较转化率的变化。
A.I中平衡时得到△n(COCl2)=0.8mol,根据方程式知,参加反应的△n(CO)=△n(COCl2)=0.8mol,则5min内, ,故A错误;
,故A错误;
B.I、III是等效平衡,升高温度平衡向吸热方向移动,III产物浓度降低,说明平衡逆向移动,则T的温度高于I的温度,即T>500℃,故B错误;
C.I中达到平衡状态时,n(CO)=n(Cl2)=1.0mol0.8mol=0.2mol,则平衡时c(CO)=c(Cl2)=![]() ,c(COCl2)=,化学平衡常数
,c(COCl2)=,化学平衡常数![]() ,温度相同化学平衡常数相同,所以II中化学平衡常数K=10,运用三段式法分析得:
,温度相同化学平衡常数相同,所以II中化学平衡常数K=10,运用三段式法分析得:
CO(g ) + Cl2(g) ![]() COCl2(g),
COCl2(g),
初始 a 0.55 0
反应0.5 0.5 0.5
平衡(a0.5) 0.05 0.5
化学平衡常数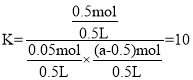 ,则a=1mol,故C正确;
,则a=1mol,故C正确;
D.I中加入1.0molCO、1.0molCl2时,CO转化率![]() ,如果起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,容器内压强小于加入1.0molCO、1.0molCl2时压强,减小压强平衡向气体体积增大的方向移动,所以CO转化率小于80%,故D正确;
,如果起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,容器内压强小于加入1.0molCO、1.0molCl2时压强,减小压强平衡向气体体积增大的方向移动,所以CO转化率小于80%,故D正确;
故选CD。

【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
【题目】已知还原性:![]() 某无色溶液中只可能含有
某无色溶液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的部分离子,进行下列实验:通过实验得出的结论正确的是
中的部分离子,进行下列实验:通过实验得出的结论正确的是![]()
实验编号 | 操作 | 现象 |
| 取10mL溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| 向 | 可得到白色沉淀 |
| 取10mL原溶液,加入过量的NaOH溶液并加热 | 产生448L气体 |
A.实验![]() 中若通入过量的
中若通入过量的![]() ,则先后氧化了
,则先后氧化了![]() 、
、![]()
B.上述3个实验不能确定是否一定含有![]() ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有
,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有![]()
C.判断溶液中是否含有钾离子,不需要通过焰色反应来检验
D.实验![]() 能够确定溶液中不含有
能够确定溶液中不含有![]()
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ. [查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
(4)硫代硫酸钠与碘反应的离子方程式为:2![]() +I2=
+I2=![]() +2I
+2I
Ⅱ. [制备产品]实验装置如图所示(省略夹持装置)
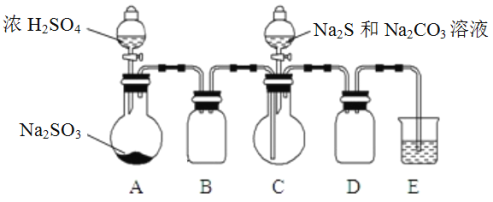
实验步骤:
(1)按如图所示组装好装置后,应先_________________________________________(填操作名称),再按图示加入试剂。仪器B和D的作用是__________________________________________;
(2)先向烧瓶C中加入Na2S和Na2CO3混合溶液,再向烧瓶A中滴加浓H2SO4。C中反应生成Na2S2O3和CO2,化学方程式为____________________________________________________________________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经蒸发、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ. [探究与反思]
(4)用I2的标准溶液测定产品的纯度。取10.0g产品,配制成100mL溶液,配制溶液的蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除_______________________________及二氧化碳。取10.00mL溶液。以________________________________溶液为指示剂,用浓度为0.10 mol/L I2的标准溶液进行滴定,相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
滴定时,达到滴定终点的现象是___________________________。Na2S2O3·5H2O在产品中的质量分数是____________________________________(用百分数表示,且保留1位小数)。

