题目内容
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
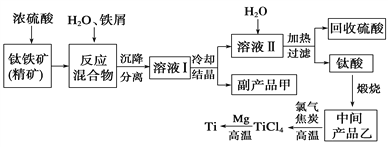
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
【答案】 FeTiO3 FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O 防止Fe2+氧化 10 TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+ TiO2+2C+2Cl2![]() TiCl4+2CO 隔绝空气 稀盐酸
TiCl4+2CO 隔绝空气 稀盐酸
【解析】本题考查化学反应原理的应用,(1)根据原子守恒,钛酸亚铁的化学式为FeTiO3,没有气体产生,且产物之一是TiOSO4,Ti的化合价没有发生变化,因此反应方程式为FeTiO3+2H2SO4═TiOSO4+FeSO4+2H2O;(2)Fe2+容易被氧气氧化,因此加入铁屑发生:Fe+2F3+=3Fe2+,即加入铁屑的目的是防止Fe2+氧化;①当Qc=Ksp时,溶液达到饱和,因此有Ksp=c(Mg2+)×c2(OH-),代入数值,求出c(OH-)=10-4mol·L-1,根据水的离子积,求出c(H+)=10-14/10-4mol·L-1,推出pH=10;②根据表格数据,TiO(OH)2的Ksp最小,先沉淀出来,因此加水稀释,白色沉淀应是TiO(OH)2,即离子反应方程式为:TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+;(3)钛酸煅烧得到TiO2,反应制备TiCl4时所加的氯气和焦炭往往是过量的,因此C应转化成CO,因此制取TiCl4的化学反应方程式为:TiO2+2C+2Cl2 ![]() TiCl4+2CO,因为镁是活泼金属,能与氧气发生反应,因此控制的条件是隔绝空气,钛是耐酸碱的金属,而镁能与酸发生反应,因此除去金属镁,可用稀盐酸或稀硫酸。
TiCl4+2CO,因为镁是活泼金属,能与氧气发生反应,因此控制的条件是隔绝空气,钛是耐酸碱的金属,而镁能与酸发生反应,因此除去金属镁,可用稀盐酸或稀硫酸。

 阅读快车系列答案
阅读快车系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2 (g) + H2 (g)![]() CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________________。
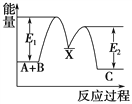
(2)该可逆反应的正反应为_____________反应(选填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为______。
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率_____(填“增大”“不变”或“减小”)。
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K__1.0(选填“>”“<”或“=”)。
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应________(填“正向” “逆向”或“处于平衡状态”)。
【题目】现有X,Y,Z,M四种元素均为短周期元素.有关信息如下表:
原子或分子结构、单质或化合物相关信息 | |
X | 含X元素的物质焰颜色反应为黄色 |
Y | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得Y的单质 |
Z | Z元素原子易失去2个电子形成8电子结构的离子 |
M | M元素原子的最外层电子数是K层电子数的3倍,M与X处于同一周期 |
(1)X元素在周期表的位置是;
(2)1个Y单质分子中含对个共用电子对;
(3)Z能在CO2气体中燃烧,其化学反应方程式为 .
(4)化合物X2M溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质X2M2 , 其溶液显黄色.则X2M2的电子式为 , 用化学方程式表示X2M溶液在空气中的变质过程 .
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:
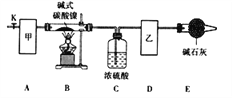
(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中________________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气,其目的是______________________________。
(3)装置A的作用是________________________________________________,若没有装置E,则会使x/z__________(填写“偏大”或“偏小”或“无影响”)。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍分解的化学方程式为_______。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。