题目内容
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2 (g) + H2 (g)![]() CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
CO (g)+H2O (g),其化学平衡常数K和温度T的关系如下表:
T/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=________________________。
(2)该可逆反应的正反应为_____________反应(选填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度满足关系式:3c(CO2)·c(H2) = 5c(CO)·c(H2O),该温度为______。
(4)若830℃时,该容器中的反应已达到化学平衡状态:
①在其他条件不变时,再向容器中充入2 mol CO2,达到新平衡后,与原平衡相比,H2的转化率_____(填“增大”“不变”或“减小”)。
②在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,其化学平衡常数K__1.0(选填“>”“<”或“=”)。
(5)若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,此时上述反应________(填“正向” “逆向”或“处于平衡状态”)。
【答案】 K = c(CO)·c(H2O)/c(CO2)·c(H2) 吸热 700℃ 增大 = 逆向
【解析】(1).因平衡常数等于生成物的平衡浓度幂之积除以反应物的平衡浓度幂之积,所以K=c(CO)c(H2O)/c(CO2)c(H2),故答案为:K= c(CO)c(H2O)/c(CO2)c(H2);
(2).化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热,故答案为:吸热。
(3).根据K=c(CO)c(H2O)/c(CO2)c(H2)可知,当3c(CO2)·c(H2) = 5c(CO)·c(H2O)时,K=3/5=0.6,故该温度为700℃,所以答案是:700℃。
(4). ①在其他条件不变时,再向容器中充入2 mol CO2,根据平衡移动原理,此时平衡正向移动,H2的消耗量增大,转化率增大,故答案为:增大。
②根据表中数据可知,当温度为830℃时,化学平衡常数K为1.0,因平衡常数的大小只与温度有关,在其他条件不变时,再向容器中充入1 mol CO、2 mol H2O,达到新平衡后,因未改变温度,故平衡常数不变,K仍然为1.0,故答案为:=。
(5). 若1200℃时,某个时刻,该密闭容器中的CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时该反应的浓度商Qc=(4 mol·L-1×4 mol·L-1)÷(2 mol·L-1×2 mol·L-1)=4,因1200℃时K=2.6,故Qc>K,则平衡逆向移动,故答案为:逆向。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
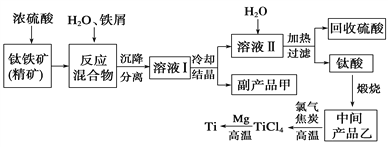
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。