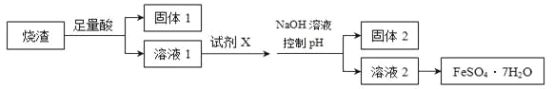
题目内容
【题目】有A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,A元素的单质常用于自来水消毒;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3 , 自然界里含量最多的是C1 , C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4.
(1)写出下列元素的元素名称:A , B .
(2)写出C1、C3两种原子的符号:C1 , C3 .
(3)A、B、E形成的一种化合物是某种家用消毒液的有效成分,其电子式是 .
(4)D的最高价氧化物的水化物与其氢化物反应形成化合物的化学式是 , 其所含化学键的类型是 . 由最常见的E原子与C2原子形成的最简单分子0.5mol中,所含中子的数目是 .
(5)C、E的单质在碱性(KOH溶液)条件下可设计成一种燃料电池,其电极反应式为(负极)(正极) .
【答案】
(1)氯;钠
(2)11H;13H
(3)![]()
(4)NH4NO3;离子键、共价键;5NA
(5)2H2+4OH﹣﹣4e﹣═4H2O;O2+2H2O+4e﹣═4OH﹣
【解析】解:A、B、C、D、E五种短周期元素,A元素的单质常用于自来水消毒,故A为Cl元素;A与B可形成BA型化合物,则B表现+1价,处于IA族,金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8个,则B为Na;C元素有三种同位素C1、C2、C3 , 自然界里含量最多的是C1 , C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍,故C是H元素;D的气态氢化物的水溶液呈碱性,而其最高价氧化物的水化物为强酸,则D为N元素;E元素原子的最外层电子数比次外层电子数多4个,原子只能有2个电子层,最外层电子数为6,故E为O元素.
(1.)由上述分析可知,A为氯元素,B为钠元素,所以答案是:氯;钠;
(2.)C为H元素,C1、C3三种原子分别为氢元素的三种核素:11H、13H,所以答案是:11H;13H;
(3.)A、B、E形成的一种化合物是某种家用消毒液的有效成分,该化合物为NaClO,其电子式是 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(4.)D的最高价氧化物的水化物与其氢化物反应形成化合物的化学式是NH4NO3 , 其所含化学键的类型是 离子键、共价键,由最常见的E原子与C2原子形成的最简单分子为12H216O,12H216O分子中,子数为10,0.5mol12H216O分子中所含中子的数目是:5NA , 所以答案是:NH4NO3;离子键、共价键;5NA;
(5.)氢气、氧气的单质在碱性(KOH溶液)条件下可设计成一种燃料电池,负极发生氧化反应,正极发生还原反应,负极上是氢气获得电子,碱性条件下生成水,负极电极反应式为:2H2+4OH﹣﹣4e﹣═4H2O,氧气在正极上获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e﹣═4OH﹣ , 所以答案是:2H2+4OH﹣﹣4e﹣═4H2O;O2+2H2O+4e﹣═4OH﹣ .

【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
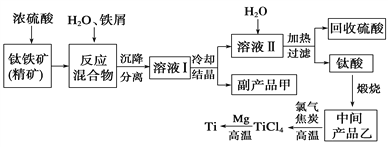
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。