题目内容
13. 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.(1)五羰基铁[Fe(CO)5]相当活泼,能吸收H2生成四羰基铁酸[H2Fe(CO)4],四羰基铁酸与NaOH反应生成的四羰基铁酸二钠水溶液呈碱性,五碳基铁吸收H2的化学式方程为Fe(CO)5+H2=H2Fe(CO)4+CO.四羰基铁酸在水溶液中的电离方程式为H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+.
(2)N2H4能使锅炉内壁的铁锈(主要成分为Fe2O3)转变成磁性氧化铁(Fe3O4)层,从而减缓锅炉锈蚀,反应过程中N2H4转化为氮气,则每生成1 molFe3O4转移电子的物质的量为1mol.
(3)分析表明,铁在浓硫酸中发生钝化时生成的氧化物中Fe、O两元素的质量比为28:11,则该氧化物的化学式为Fe8O11.
(4)常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4.若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=3.
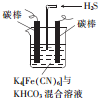
(5)工业上常采用如图所示的电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫.先通过电解,电解一段时间后通入H2S时发生反应的离子方程式为2[Fe(CN)4]3-+2CO32-+H2S═2[Fe(CN)4]4-+2HCO3-+S↓.电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-;电解过程中阴极区溶液的pH变大(填“变大”“变小”或“不变”).
(6)纳米级Fe3O4是磁流体中的重要粒子,常温下降NH3通入1L含0.1 molFe2(SO4)3和1.0mol FeSO4的酸性混合溶液中至pH=10时,可得到纳米级Fe3O4.
①含1.0 molFe2(SO4)3和1.0mol FeSO4的1L酸性混合溶液中,c(SO42-):[c(Fe3+)+c(Fe2+)]>(填“>”“<”或“=”)4:3.
②当通入NH3至溶液的pH值为3时,所得溶液中c(Fe2+):c(Fe3+)=2.5×104.(溶液体积变化忽略不计,Ksp[Fe(OH)2]=8.0×10-16,Ksp[Fe(OH)3]=4.0×10-38).
分析 (1)氢化羰基铁为二元弱酸,结合原子守恒分析书写化学方程式;氢化羰基铁为二元弱酸,在溶液中分两步电离;
(2)根据Fe3O4可以写成FeO•Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价来解答;
(3)由铁元素与氧元素的质量比得出该氧化物中铁与氧的个数比,据此写出化学式即可;
(4)依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断;
(6)①Fe3+和Fe2+在溶液中发生水解反应,其物质的量减少;
②pH为3时,c(OH-)=10-11mol/L,结合Ksp(Fe(OH)2)=c(Fe2+)×c2(OH-)=8.0×10-38,Ksp(Fe(OH)3)=c(Fe3+)×c3(OH-)=4.0×10-38计算c(Fe2+):c(Fe3+).
解答 解:(1)Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼,易于吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠,依据题干信息推知,反应的化学方程式为:Fe(CO)5+H2=H2Fe(CO)4+CO;
氢化羰基铁为二元弱酸,在溶液中分两步电离,其电离方程式为:H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+;
故答案为:Fe(CO)5+H2=H2Fe(CO)4+CO;H2Fe(CO)4?HFe(CO)4-+H+,HFe(CO)4-?Fe(CO)42-+H+;
(2)因Fe3O4可以写成FeO•Fe2O3,可知1个Fe3O4中有2个铁为+3价,1个铁为+2价,所以由Fe2O3形成一个Fe3O4得到1个电子,则每生成1mol Fe3O4,转移电子的物质的量为1mol;
故答案为:1mol;
(3)设该氧化物的化学式为FexOy,
则56x:16y=28:11,
所以x:y=8:11.
故该化学式为:Fe8O11.
故答案为:Fe8O11;
(4)2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:3;
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,则阳极的反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,由于CO32-的水解程度大于HCO3-,所以碱性增强,则pH变大;
故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;变大;
(6)①Fe3+和Fe2+在溶液中发生水解反应,其物质的量减少,则1.0 molFe2(SO4)3和1.0mol FeSO4的混合溶液中Fe3+和Fe2+的物质的量之和小于3mol,而硫酸根离子的物质的量为4mol,所以c(SO42-):[c(Fe3+)+c(Fe2+)]>4:3;
故答案为:>;
②pH为3时,c(OH-)=10-11mol/L,则1.0mol FeSO4溶液中c(Fe2+)×c2(OH-)=10-22<8.0×10-16,没有沉淀生成,则c(Fe2+)=1.0mol/L,
由Ksp(Fe(OH)3)=4.0×10-38可知,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-11})^{3}}$mol/L=4×10-5mol/L,则c(Fe2+):c(Fe3+)=2.5×104,
故答案为:2.5×104.
点评 本题以铁的化合物的性质为知识背景,考查了弱电解质的电离、盐的水解原理的应用、电解原理的应用、溶度积常数的计算等,题目综合性较强,难度较大,侧重于考查学生对基础知识的综合应用能力和计算能力.

| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 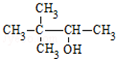 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
| A. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| B. | 绿矾、碱石灰、苏打、干冰分别属于纯净物、混合物、电解质、非电解质 | |
| C. | 乙烯水化、铁铝钝化、植物油氢化、纯碱晶体风化等过程中都包含化学变化 | |
| D. | 蛋白质、纤维素、硝化纤维等都是高分子化合物 |

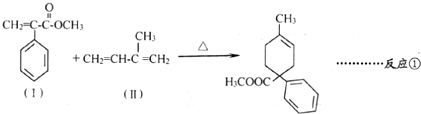
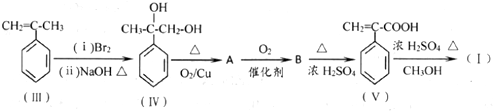
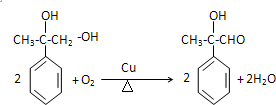 .
. 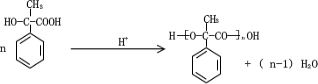 .
.  .
. 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案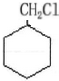 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$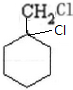
 很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
很多金属、非金属及其化合物在科学研究和工业生产中都有重要用途.回答下列有关问题:
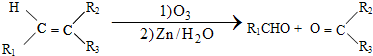
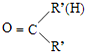 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +H2O
+H2O +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
 .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
 .
.