题目内容
1.成环是有机合成的重要环节.如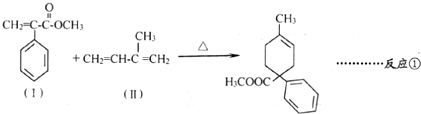
化合物(Ⅰ)可由(Ⅲ)合成:
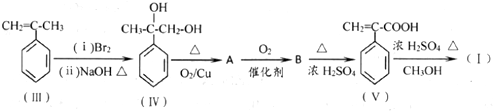
(1)写出(Ⅳ)→A 的化学方程式
 .
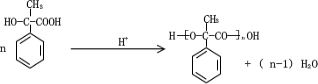
. (2)酸性条件下,化合物B能发生聚合反应,化学方程式为
 .
. (3)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为
 .
.(4)请用合成反应流程图表示出由
 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$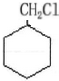 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$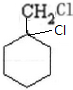
$→_{△}^{NaOH的水溶液}$
 .
. (合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$ B…$→_{反应条件}^{反应试剂}$目标产物)
分析 III先和溴发生加成反应生成溴代烷,溴代烷再和NaOH的水溶液加热发生取代反应生成IV,IV发生氧化反应生成A,A结构简式为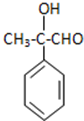 ,A发生氧化反应生成B,B结构简式为
,A发生氧化反应生成B,B结构简式为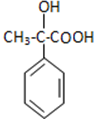 ,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
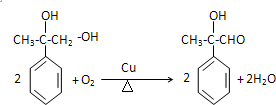
(1)(Ⅳ)在Cu作催化剂、加热条件下发生氧化反应生成A;
(2)酸性条件下,化合物B能发生聚合反应生成高分子化合物;
(3)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为 ;
;
(4)在催化剂条件下, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,
, 和氢氧化钠的醇溶液加热发生消去反应生成
和氢氧化钠的醇溶液加热发生消去反应生成 ,
, 和Cl2发生加成反应生成
和Cl2发生加成反应生成 ,
, 和NaOH的水溶液加热发生取代反应生成
和NaOH的水溶液加热发生取代反应生成 .
.
解答 解:III先和溴发生加成反应生成溴代烷,溴代烷再和NaOH的水溶液加热发生取代反应生成IV,IV发生氧化反应生成A,A结构简式为 ,A发生氧化反应生成B,B结构简式为
,A发生氧化反应生成B,B结构简式为 ,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
,B发生消去反应生成V,V和甲醇在浓硫酸作催化剂、加热条件下发生酯化反应生成I,
(1)(Ⅳ)在Cu作催化剂、加热条件下发生氧化反应生成A,反应方程式为 ,
,
故答案为: ;
;
(2)酸性条件下,化合物B能发生聚合反应生成高分子化合物,反应方程式为 ,
,
故答案为: ;
;
(3)(Ⅲ)与(Ⅱ)也能发生类似反应①的反应,生成含两个六元环的化合物的结构简式为 ,故答案为:
,故答案为: ;
;
(4)在催化剂条件下, 和氢气发生加成反应生成
和氢气发生加成反应生成 ,
, 和氢氧化钠的醇溶液加热发生消去反应生成
和氢氧化钠的醇溶液加热发生消去反应生成 ,
, 和Cl2发生加成反应生成
和Cl2发生加成反应生成 ,
, 和NaOH的水溶液加热发生取代反应生成
和NaOH的水溶液加热发生取代反应生成 ,其流程图为:
,其流程图为: $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$ $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$ $→_{△}^{NaOH的水溶液}$
$→_{△}^{NaOH的水溶液}$ ,
,
故答案为: $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$ $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$ $→_{△}^{NaOH的水溶液}$
$→_{△}^{NaOH的水溶液}$ .
.
点评 本题考查有机合成,为高频考点,涉及合成路线的设计、有机物的推断等知识点,综合性较强,根据反应条件、分子式、结构简式进行推断,难点是(4)题合成路线设计,要求学生熟练掌握常见有机反应类型、反应条件、有机物结构和性质,题目难度中等.

| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
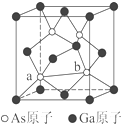 元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等.这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用.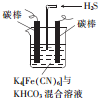 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.