题目内容
2.关于下列说法错误的是( )| A. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| B. | 绿矾、碱石灰、苏打、干冰分别属于纯净物、混合物、电解质、非电解质 | |
| C. | 乙烯水化、铁铝钝化、植物油氢化、纯碱晶体风化等过程中都包含化学变化 | |
| D. | 蛋白质、纤维素、硝化纤维等都是高分子化合物 |
分析 A.甲醇、乙二醇和丙三醇含有的官能团的数目不同;H2、D2、T2均为氢单质;
B.纯净物是指由同种物质组成的,混合物是指由不同种物质组成的,电解质是指在水溶液里或熔化状态下能够导电的化合物,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物;
C.乙烯水化生成乙醇、铁铝钝化生成致密的氧化膜、植物油氢化时双键发生加成反应、纯碱晶体风化失去结晶水;
D.相对分子质量在10000以上的化合物为高分子.
解答 解:A.甲醇、乙二醇和丙三醇含有的官能团的数目不同,不是同系物;H2、D2、T2均为氢单质,为同种物质,故A错误;
B.绿矾有固定组成,为纯净物;碱石灰为CaO、NaOH的混合物;苏打在水中或熔化均可电离,为电解质;干冰本身不能电离,为非电解质,故B正确;
C.乙烯水化生成乙醇、铁铝钝化生成致密的氧化膜、植物油氢化时双键发生加成反应、纯碱晶体风化失去结晶水,均有新物质生成,均发生化学变化,故C正确;
D.蛋白质、纤维素、硝化纤维等物质相对分子质量在10000以上,则均属于高分子化合物,故D正确;
故选A.
点评 本题考查较综合,涉及有机物的官能团、物质分类、有机反应等,注重基础知识的考查和夯实,综合性较强,注意相关的概念及辨析,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
10.室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中溶液的描述正确的是( )
| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
17.如表有关实验现象、解释和结论都正确的一项是( )
| 实验操作 | 实验现象 | 解释或结论 | |
| A | 加热(170℃)乙醇与浓硫酸混合物,将产生的气体直接通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液紫红色逐渐变浅 | 可能产生了SO2气体 |
| B | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分为两层,下层是紫红色 | KI和氯水及苯发生反应 |
| C | 将少量SO2通入苯酚钠溶液中,振荡 | 溶液中出现浑浊 | 因为发生了反应: C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D | 把浓氨水加入到盛有Cu2O的试管中 | 溶液先无色,静置一段时间后变成蓝色 | Cu+被空气氧化成了Cu2+、使溶液显蓝色 |
| A. | A | B. | B | C. | C | D. | D |
14.下列说法不正确的是( )
| A. |  按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 按系统命名法,如图有机物的命名为2,3-二甲基-3-乙基戊烷 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单元链节是乙炔 | |
| C. | 总物质的量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 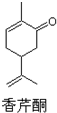 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 化学式为C10H14O,可以发生取代反应、聚合反应和氧化反应 |
9.将足量的CO2通入下列溶液中,最终溶液浑浊的是( )
①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙.
①饱和苏打溶液 ②水玻璃 ③氯化钡 ④次氯酸钙.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①②③④ |
 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.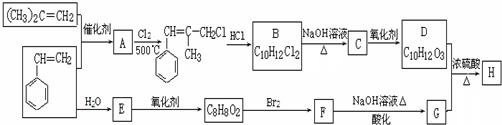
 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$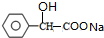 +NaBr+H2O.
+NaBr+H2O.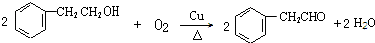 .
.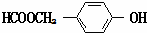 (写结构简式).
(写结构简式).