题目内容
6.下列关于短周期元素单质间的置换反应的判断错误的是( )| A. | 金属单质可置换出非金属单质 | B. | 单质所属元素不一定是同主族元素 | ||
| C. | 单质可同为气态,也可同为固态 | D. | 均可在常温下进行反应 |
分析 置换反应的定义为一种化合物与一种单质生成另外一种化合物和另外一种单质的反应,依据此定义找出具体的实例判断即可.
解答 解:A、金属镁能在二氧化碳气体中燃烧,反应生成MgO和C,属于金属单质置换非金属单质,故A正确;
B、氟气与水反应生成氧气,属于置换反应,F与O处于不同的主族,故B正确;
C、氟气置换氧气同为气态,金属Mg置换C同属于固态,故C正确;
D、金属镁与二氧化碳的置换反应需要加热,常温下不能进行,故D错误,故选D.
点评 本题主要考查的是置换反应的定义以及常见的置换反应,熟练记忆前18号元素的具体性质是解决本题的关键,难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
17.C、Si、S都是重要的非金属元素,以下说法正确的是( )
| A. | 三者的氧化物均为酸性氧化物 | |
| B. | 三者的单质均存在同素异形现象 | |
| C. | CO2、SiO2、SO3都能与H2O反应,其反应类型相同 | |
| D. | 25℃时,物质的量浓度相同的三溶液的pH:Na2SiO3<Na2SO3<Na2CO3 |
18.几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| D. | Y的最高价氧化物对应的水化物能溶于稀氨水 |
 ;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka=4×10-12
;取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),此时测得溶液的pH=12,则此条件下G中阴离子的电离平衡常数Ka=4×10-12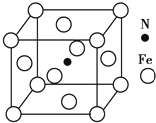 铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂.
铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(-NO2)还原为氨基(-NH2);在苯的溴代反应中用溴化铁作催化剂. .Fe基态原子核外电子排布式为[Ar]3d64s2.
.Fe基态原子核外电子排布式为[Ar]3d64s2. ,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.
,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.