题目内容
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
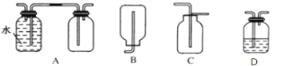
①仪器m的名称为____________,装置F中试剂的作用是____________。
②装置连接顺序:A→________→________→________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
![]()
①W溶液可以是____________(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________(用含V、m的式子表示)。
【答案】直形冷凝管(或冷凝管) 除去Cl2中混有的HCl杂质 F C B 将装置内的氯气排入D内吸收以免污染空气,并将B中残留的S2Cl2排入E中收集 滴入浓盐酸的速率(或B中通入氯气的量,其他合理答案均得分) S2Cl2遇水会分解放热,放出腐蚀性烟气 ac ![]()
【解析】
(1)实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2,利用装置A制备氯气,氯气中含氯化氢气体和水蒸气,通过装置F除去氯化氢,通过装置C除去水蒸气,通过装置B和硫磺反应在110~140℃反应制得S2Cl2粗品,通过装置E冷凝得到二氯化二硫(S2Cl2),连接装置D是防止空气中水蒸气进入;
(2)S2Cl2受热或遇水分解放热,放出腐蚀性烟气;
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数,混合气体通过溶液W溶液吸收二氧化硫气体得到溶液中加入加入过量氢氧化钡溶液反应得到硫酸钡沉淀,过滤洗涤干燥称量得到硫酸钡沉淀质量mg,元素守恒计算二氧化硫体积分数。
(1)①仪器m 的名称为直形冷凝管(或冷凝管),装置F 中试剂的作用是:除去Cl2中混有的HCl杂质;
②利用装置A制备氯气,氯气中含氯化氢气体和水蒸气,通过装置F除去氯化氢,通过装置C除去水蒸气,通过装置B和硫磺反应在110~140℃反应制得S2Cl2粗品,通过装置E冷凝得到二氯化二硫(S2Cl2),连接装置D是防止空气中水蒸气进入,依据上述分析可知装置连接顺序为:A→F→C→B→E→D;
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是:将装置内的氯气排入D内吸收以免污染空气;并将B中残留的S2Cl2排入E中收集;
④反应生成S2Cl2的氯气过量则会生成SCl2,温度过高S2Cl2会分解,为了提高S2Cl2的纯度,实验的关键是控制好温度和滴入浓盐酸的速率或B中通入氯气的量;
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬独液,但不要对泄漏物或泄漏点直接喷水,其原因是:防止S2Cl2遇水分解放热,放出腐蚀性烟气;
(3)W溶液的作用是氧化二氧化硫生成硫酸,可以选择H2O2溶液或氯水,但不能选择KMnO4溶液(硫酸酸化),因为酸性高锰酸钾溶液能氧化氯化氢生成氯气,污染环境,且引入硫酸根离子,故答案为ac;
②过程分析可知生成沉淀为硫酸钡沉淀,硫元素守恒得到二氧化硫物质的量n(SO2)=n(BaSO4)=![]() =
=![]() mol,该混合气体中二氧化硫的体积分数为气体物质的量分数,二氧化硫体积分数
mol,该混合气体中二氧化硫的体积分数为气体物质的量分数,二氧化硫体积分数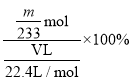 =
=![]() 。
。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,__(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有__。
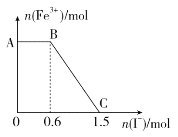
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是__(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于__(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据__现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的__溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是__,操作及现象是__。
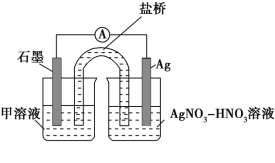
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:__。
【题目】工业上可用一氧化碳合成可再生能源甲醇。
(1)已知:Ⅰ.3CO(g)+6H2(g) ![]() CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
CH3CH=CH2(g)+3H2O(g) △H1=-301.3kJ/mol;
Ⅱ.3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol。
则CO与H2合成气态甲醇的热化学方程式为___________________________________
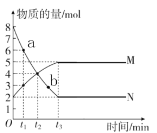
(2)某科研小组在Cu2O/ZnO作催化剂的条件下,在500℃时,研究了n(H2)∶n(CO)分别为2∶1、5∶2时CO的转化率变化情况(如图1所示),则图中表示n(H2)∶n(CO)=2∶1的变化曲线为________(填“曲线a”或“曲线b”),原因是_________________。

(3)某科研小组向密闭容器中充入一定量的CO和H2合成气态甲醇,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH3OH的产率与温度的关系如图2所示。下列说法正确的是____________(填选项字母)。
a.使用催化剂A能加快相关化学反应速率,但催化剂A并未参与反应
b.在恒温恒压的平衡体系中充入氩气,CH3OH的产率降低
c.当2v(CO)正=v(H2)逆时,反应达到平衡状态
(4)一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 2 mol CO、6 mol H2 | a mol CO、b mol H2、c mol CH3OH(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始时的![]() ,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
,则该温度下,该反应的平衡常数K=_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_____________________________________。
(5)CO与日常生产生活相关。

①检测汽车尾气中CO含量,可用CO分析仪,工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-。则负极的电极反应式为__________________。
②碳酸二甲酯[(CH3O)2CO]毒性小,是一种绿色化工产品,用CO合成(CH3O)2CO,其电化学合成原理为4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________
2(CH3O)2CO+2H2O,装置如图3所示:写出阳极的电极反应式:________________________________________