题目内容
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是_________mol;
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是____________,又变为棕黄色的原因是用离子方程式解释____________;
(3)在100mL FeBr2溶液中通入标况下2.24LCl2,溶液中有1/4的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________。
【答案】0.032 2Fe3++SO32- +H2O =2Fe2++SO42- +2H+ 3Fe2++4H++NO3- =3Fe3++NO↑+2H2O 4/3mol/L
【解析】
(1)首先计算出n(KI),与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,再计算出n(I2)=n(KIO3),结合化合价升降守恒计算消耗KMnO4的物质的量;
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,原因是Fe3+与SO32-发生氧化还原反应生成Fe2+和SO42-,反应后溶液呈酸性,则在酸性条件下NO3-与Fe2+反应生成Fe3+,过一会又变为棕黄色;
(3)还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,根据电子转移守恒计算出FeBr2的物质的量,再根据c=![]() 计算FeBr2溶液的物质的量浓度。
计算FeBr2溶液的物质的量浓度。
(1)300mL 0.2mol/L的KI溶液中:n(KI)=0.2mol/L×0.3L=0.06mol,与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则n(I2)=n(KIO3)=0.02mol,失电子的物质的量为:2×0.02mol+0.02mol×[5-(-1)]=0.16mol,1mol MnO4-得电子5mol,根据得失电子数目相等,则消耗KMnO4的物质的量为![]() =0.032mol,故答案为:0.032;
=0.032mol,故答案为:0.032;
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,原因是Fe3+与SO32-发生氧化还原反应生成Fe2+和SO42-,反应的离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,反应后溶液呈酸性,则在酸性条件下,H+与NO3-组成的硝酸把Fe2+氧化成Fe3+,过一会又变为棕黄色,反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;3Fe2++4H++NO3-=3Fe3++NO↑+H2O;
(3)标准状况下,2.24L氯气的物质的量为![]() =0.1mol,还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,设原溶液中FeBr2的物质的量为amol,根据电子转移守恒,则:amol×(3-2)+
=0.1mol,还原性Fe2+>Br-,氯气先氧化亚铁离子,亚铁离子反应完毕,再氧化溴离子,设原溶液中FeBr2的物质的量为amol,根据电子转移守恒,则:amol×(3-2)+![]() ×2×amol×[0-(-1)]=0.1mol×2,解得:a=
×2×amol×[0-(-1)]=0.1mol×2,解得:a=![]() mol,原FeBr2溶液的物质的量浓度为
mol,原FeBr2溶液的物质的量浓度为 =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() 。
。

 综合自测系列答案
综合自测系列答案【题目】一种生产聚苯乙烯的流程如下,下列叙述不正确的

A.乙苯的分子式为C8H10B.聚苯乙烯属于高分子化合物
C.lmol苯乙烯最多可与3mol H2发生加成反应D.鉴别苯与苯乙烯可用酸性KMnO4溶液
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
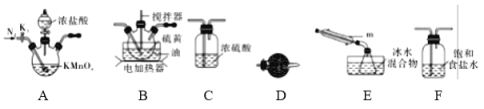
①仪器m的名称为____________,装置F中试剂的作用是____________。
②装置连接顺序:A→________→________→________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
![]()
①W溶液可以是____________(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________(用含V、m的式子表示)。