题目内容
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,__(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有__。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是__(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于__(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据__现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的__溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
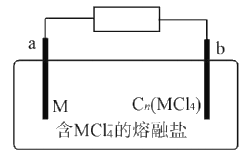
实验Ⅱ:装置如图。其中甲溶液是__,操作及现象是__。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:__。
【答案】加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀 Fe2+ Fe+2Fe3+=3Fe2+ 4Fe2++O2+4H+=4Fe3++2H2O 加入KSCN溶液后产生白色沉淀 0.05mol·L-1NaNO3溶液 FeSO4溶液(或FeCl2溶液) 分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深 溶液中存在反应:①Fe+2Ag+=Fe2++2Ag,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小
【解析】
(1)①取出少量黑色固体,洗涤后,加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀,证明黑色固体中含有Ag。故答案为:加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀;
②由操作和现象可知为Fe2+的检验,加入铁氰化钾溶液有蓝色沉淀生成,说明溶液中有Fe2+,故答案为:Fe2+;
(2)乙认为铁粉过量时不可能有Fe3+,因铁粉过量时会与Fe3+发生反应,方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
②假设b:当空气中的O2存在时,Fe2+会与之发生4Fe2++O2+4H+═4Fe3++2H2O,可能产生Fe3+;
假设d:当溶液中存在Ag+时,Ag+与SCN-会发生反应Ag++SCN-═AgSCN↓,故溶液产生白色沉淀,若随时间变长,白色沉淀减少,红色加深,说明溶液中有Fe3+。
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;加入KSCN溶液后产生白色沉淀;
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:证明假设a、b、c错误,就是排除Ag+对实验的干扰,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用0.05mol·L-1NaNO3溶液。
实验Ⅱ:原电池实验需要证明的是假设d的反应Ag++Fe2+=Ag+Fe3+能够实现,所以甲池应当注入FeCl2(或者FesO4溶液)。假设d成立,则上述原电池中能够产生电流,左侧溶液中生成的Fe3+遇到KSCN时红色会更深。其中甲溶液是FeSO4溶液(或FeCl2溶液),操作及现象是分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深。
故答案为:0.05mol·L-1NaNO3溶液;FeSO4溶液(或FeCl2溶液);分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深;
(3)由于加入过量铁粉,溶液中存在反应有①Fe+2Ag+=Fe2++2Ag,反应生成的Fe2+能够被Ag+氧化发生反应②Ag++Fe2+=Ag+Fe3+,生成的Fe与过量铁粉发生反应③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。
故答案为:溶液中存在反应:①Fe+2Ag+=Fe2++2Ag,②Ag++Fe2+=Ag+Fe3+,③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30分钟后,c(Ag+)小,以反应③为主,c(Fe3+)减小。

【题目】一种生产聚苯乙烯的流程如下,下列叙述不正确的
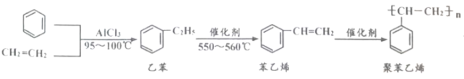
A.乙苯的分子式为C8H10B.聚苯乙烯属于高分子化合物
C.lmol苯乙烯最多可与3mol H2发生加成反应D.鉴别苯与苯乙烯可用酸性KMnO4溶液
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
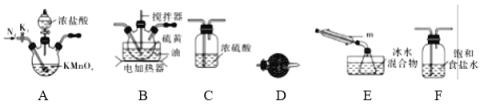
①仪器m的名称为____________,装置F中试剂的作用是____________。
②装置连接顺序:A→________→________→________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
![]()
①W溶液可以是____________(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________(用含V、m的式子表示)。