题目内容
【题目】一定温度下,在容积为2 L的密闭容器内, 某一反应中气体M和气体N的物质的量随反应时间变化的曲线如图所示, 请根据图示回答下列问题。
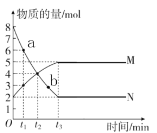
(1)写出该反应的化学方程式:____________。
(2)t1~t3时间段,以M的浓度变化表示的平均反应速率为________(用含t1、t3的式子表示)。
(3)比较a点与b点反应速率大小,Va___Vb(填“>”“=” 或 “< ”)。
(4)如图所示的三个时刻中,___________(填t1、t2或t3)时刻处于平衡状态。
(5)下列叙述中,能说明该反应达到平衡状态的是________。
A.容器内M与N的物质的量相等
B.容器内M与N的浓度不随时间变化
C.单位时间内每消耗1 mol N,同时生成0.5 mol M
D.容器内压强不随时间变化
【答案】2N(g) ![]() M(g)
M(g) ![]() mol·L-1·min-1 > t3 BD
mol·L-1·min-1 > t3 BD
【解析】
由图象中的信息可判断反应物与生成物,根据变化量写出化学方程式;根据题图中信息求出t1~t3时间段V(M)的值及判断a、b两点速率大小关系;根据化学平衡状态的特征分析判断化学平衡状态和达到化学平衡状态的标志。
(1)由图可知,物质N的物质的量减少,物质M的物质的量增加,则反应物为N,生成物为M,得到![]() ,所以反应的化学方程式为:2N(g)
,所以反应的化学方程式为:2N(g) ![]() M(g);答案为2N(g)
M(g);答案为2N(g) ![]() M(g)。
M(g)。
(2)t1到t3时间段,以M的浓度变化表示的平均反应速率为:v(M)= 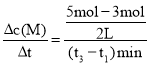 =
=![]() molL-1min-1;答案为
molL-1min-1;答案为![]() molL-1min-1。
molL-1min-1。
(3)由图可知,a、b均在N曲线上,a点对应的N的浓度大于b点对应的N的浓度,浓度越大,反应速率越快,所以Va>Vb;答案为>。
(4)因物质的量随时间的变化而不发生变化时为平衡状态,由图可知,t3为平衡状态,且平衡时正逆反应速率相等;答案为t3。
(5)A.由图可知t2时M与N的物质的量相等,但随时间的变化,它们的物质的量在变化,则不是平衡状态,故A不符合题意;
B.容器内M与N的浓度不随时间变化,说明V正=V逆,达到平衡状态,B符合题意;
C.单位时间内消耗1molN的同时生成0.5molM,只能说明单方向N、M的关系,不能说明正逆反应速率相等的关系,故C不符合题意;
D.因该反应是物质的量在减少的化学反应,物质的量与压强成正比,则混合气体的压强不随时间的变化而变化,则物质的量也不再改变,浓度也不再改变,达到平衡状态,故D符合题意;
答案为BD。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
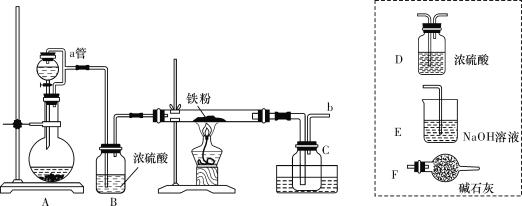
课课优能力培优100分系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
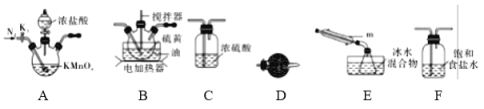
①仪器m的名称为____________,装置F中试剂的作用是____________。
②装置连接顺序:A→________→________→________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________。
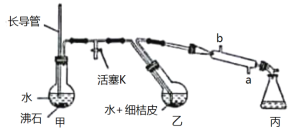
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
![]()
①W溶液可以是____________(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________(用含V、m的式子表示)。
【题目】CO2的资源化利用一直是化学家们关注的重要课题,中科院大连化学物理研究所设计了一种新型多功能复合催化剂,成功地实现了CO2直接加氢制取高辛烷值汽油:5CO2(g)+16H2(g)=C5H12(l)+10H2O(l) ΔH=+a kJ/mol (反应①),该研究成果被评价为“CO2催化转化领域的突破性进展”。
(1)已知氢气的燃烧热为286 kJ/mol,若要利用H2的燃烧热求a的值,则还需要知道一个反应的ΔH,该反应是___________。反应①在一定条件下具有自发性,则a_____0(填“>”或“<”)。
(2)向某密闭容器中按一定投料比充入 CO2、H2,控制条件使其发生反应:5CO2(g)+16H2(g)![]() C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
C5H12(1)+10H2O(1) ΔH。 测得H2的平衡转化率与温度、压强之间的关系如图所示:
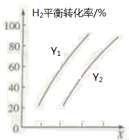
则X表示____________,Y1____________Y2(填“>”或“<”)。欲提高H2的平衡转化率并提高单位时间内C5H12(l)的产量,可采取的措施是_________(填两种)。
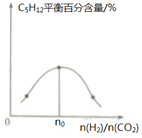
(3)控制一定温度、催化剂,按不同投料比[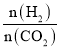 ]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
]将反应物通入到某密闭容器中,测得平衡时C5H12的百分含量与投料比之间的关系如图所示,则n0=_____________。
(4)在钌一铑双金属催化剂的作用下,CH3OH、CO2、H2可高效地转化为乙酸,反应方程式为CH3OH(g)+CO2(g)+H2(g)![]() CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
CH3COOH(g)+H2O(g) ΔH<0。一定温度下,向某刚性容器中通入等物质的量的三种原料气,测得体系中的总压强与时间的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
p/kPa | 3 | 2.7 | 2.5 | 2.35 | 2.26 | 2.2 | 2.2 |
则反应开始到达平衡的过程中,v(CO2)=________kPa/min,Kp=_______span>kPa-1。
(5)碳捕捉技术的发展也有利于CO2在资源应用方面得到充分利用。常温下,若某次用NaOH溶液捕捉空气中的CO2所得溶液的pH=10,并测得溶液中c(HCO3-)=2c(CO32-),则Ka2(H2CO3)=_______mol/L。