题目内容
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是

A. 当a、b都是铜作电极时,电解的总反应方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
C. 当燃料电池消耗22.4 L甲醛气体时,电路中理论上转移2 mol e-
D. 燃料电池工作时,负极反应为HCHO+H2O-2e-===HCOOH+2H+
【答案】D
【解析】
左边装置是酸性甲醛燃料电池,原电池放电时,燃料失去电子发生氧化反应,所以通入燃料的电极为负极,通入氧气的电极为正极,正极上氧化剂得到电子发生还原反应,由于电解质溶液呈酸性,正极上电极反应为O2+4H++4e-=2H2O,右边装置有外界电源,所以是电解池,连接负极的a电极时阴极,连接正极的b极是阳极,阳极上失去电子发生氧化反应,阴极上得到电子发生还原反应。
A. 当a、b都是铜作电极时,形成电解精炼装置,阳极铜失去电子,阴极上铜离子得到电子,故错误;B.由于电解质溶液呈酸性,正极反应为O2+4H++4e-=2H2O ,故错误;C. 当燃料电池消耗22.4 L甲醛气体时,由于没有说明是在标况下,所以无法计算甲醛的物质的量,则无法计算转移电子的物质的量,故错误;D. 燃料电池工作时,甲醛在负极上失去电子生成甲酸,则负极反应为HCHO+H2O-2e-=HCOOH+2H+,故正确。故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
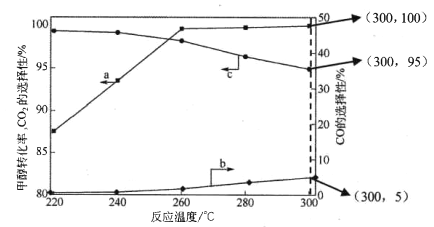
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)===HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:______________________________________________。
②在上述制备甲醛时,常向反应器中通入适当过量的氧气,其目的_________________。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)==CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/(kJ·mol-1) | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题:
①图1中曲线a到曲线b的措施是_________。

②已知CO中的C与O之间为叁键,其键能为x kJ/mol,则x=________。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为______________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为________。
(4)电解水蒸气和CO2产生合成气(H2
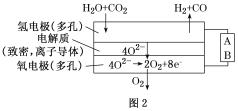
【题目】为探究影响化学反应速率的因素:在25mL 5%的H2O2溶液中,如表格中条件,产生等体积氧气时,所消耗时间最短的是:
组别 | V(1mol/L FeCl3)/mL | 蒸馏水/mL | 温度/℃ |
A | 2 | 2 | 50 |
B | 3 | 1 | 40 |
C | 2 | 2 | 40 |
D | 3 | 1 | 50 |
A.AB.BC.CD.D



