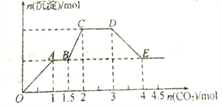
��Ŀ����
����Ŀ���ڻ���ƽ�����װ�л�ԭ����(N2H4)��ǿ������H2O2�������ǻ��ʱ�������������ĵĵ�����ˮ���������ų���������������֪0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������
��1��д���º�������Ľṹʽ��_______����������_________��
��2��������ӦӦ���ڻ���ƽ��������ͷų����������Ϳ��ٲ������������⣬����һ����ͻ�����ŵ���______��
��3��д���º�˫��ˮ��Ӧ���Ȼ�ѧ����ʽ___________��
��4����֪H2O��l���TH2O��g������H=+44KJ/mol����16gҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ���ų���������_________��
��5����֪��
N2��g��+2O2��g��=2NO2��g����H=+67.7kJ/mol
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-543kJ/mol
������NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪ________��
���𰸡� ![]() H-O-O-H ����Ϊ������ˮ������Ⱦ N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.6kJ/mol 408.8kJ 2N2H4��g��+2NO2��g���T3N2��g��+4H2O��g����H=-1135.7KJ/mol
H-O-O-H ����Ϊ������ˮ������Ⱦ N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.6kJ/mol 408.8kJ 2N2H4��g��+2NO2��g���T3N2��g��+4H2O��g����H=-1135.7KJ/mol
����������1��N2H4��Nԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ��Hԭ�������γ�1�Թ��õ��Ӷԣ��ṹʽΪ![]() ��H2O2��Oԭ��֮���γ�1�Թ��õ��Ӷԣ�Oԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH-O-O-H�� ��2������N2H4����H2O2��Ӧ������Ϊ������ˮ������Ⱦ��ͻ�����ŵ��ǣ�����Ϊ������ˮ������Ⱦ����3��0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������1molҺ̬�·ų�������Ϊ
��H2O2��Oԭ��֮���γ�1�Թ��õ��Ӷԣ�Oԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ��ṹʽΪH-O-O-H�� ��2������N2H4����H2O2��Ӧ������Ϊ������ˮ������Ⱦ��ͻ�����ŵ��ǣ�����Ϊ������ˮ������Ⱦ����3��0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������1molҺ̬�·ų�������Ϊ![]() =641.625kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����4����֪����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����H2O��l���TH2O��g����H=+44KJ/mol�����ݸ�˹���ɣ���-����4��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-817.625kJ/mol��16gҺ̬�µ����ʵ���Ϊ
=641.625kJ���÷�Ӧ�Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����4����֪����N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-641.625kJ/mol����H2O��l���TH2O��g����H=+44KJ/mol�����ݸ�˹���ɣ���-����4��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=-817.625kJ/mol��16gҺ̬�µ����ʵ���Ϊ ![]() =0.5mol����ȫ��Ӧ����Һ̬ˮʱ�ų�������Ϊ0.5mol��817.625kJ/mol=408.8kJ����5����֪����N2 ��g��+2O2��g��=2NO2 ��g����H1=+67.7kJ/mol������N2H4��g��+O2 ��g��=N2��g��+2H2O ��g����H2=-543kJ/mol
=0.5mol����ȫ��Ӧ����Һ̬ˮʱ�ų�������Ϊ0.5mol��817.625kJ/mol=408.8kJ����5����֪����N2 ��g��+2O2��g��=2NO2 ��g����H1=+67.7kJ/mol������N2H4��g��+O2 ��g��=N2��g��+2H2O ��g����H2=-543kJ/mol
���ݸ�˹���ɣ����2-���2N2H4��g��+2NO2��g���T3N2��g��+4H2O��g����H=2��H2-��H1=-1153.7KJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�