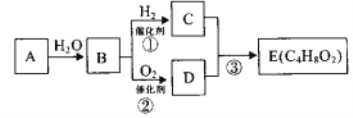
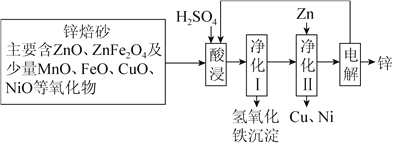
题目内容
【题目】100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
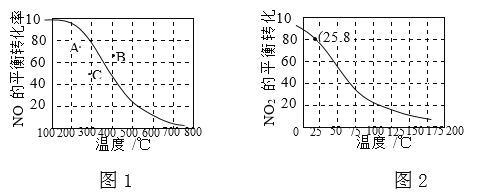
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
【答案】 B 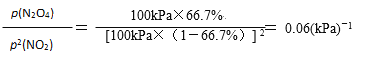
【解析】试题分析:图1中曲线表示的是压强为P时,不同温度时的平衡转化率;A、C两点的平衡转化率低于相应温度下的平衡转化率,说明改变压强平衡逆向移动;B点的平衡转化率高于相应温度下的平衡转化率,说明改变压强平衡正向移动;②利用“三段式”计算平衡常数;
解析:2NO(g)+O2(g)![]() 2NO2(g),增大压强平衡正向移动、减小压强平衡逆向移动;图1中曲线表示的是压强为P时,不同温度时的平衡转化率;A、C两点的平衡转化率低于相应温度下的平衡转化率,平衡逆向移动,说明压强小于P;B点的平衡转化率高于相应温度下的平衡转化率,平衡正向移动,说明压强大于P;所以B点对应的压强最大。
2NO2(g),增大压强平衡正向移动、减小压强平衡逆向移动;图1中曲线表示的是压强为P时,不同温度时的平衡转化率;A、C两点的平衡转化率低于相应温度下的平衡转化率,平衡逆向移动,说明压强小于P;B点的平衡转化率高于相应温度下的平衡转化率,平衡正向移动,说明压强大于P;所以B点对应的压强最大。
②设开始NO2的浓度是amol/L,
2NO2(g)![]() N2O4(g)
N2O4(g)
开始 a 0
转化 0.8a 0.4a
平衡 0.2a 0.4a
![]()
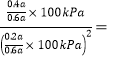
![]() 。
。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】甲醇是重要的化工基础原料和清洁液体燃料,工业上可利用CO或CO2来生产甲醇。已知制备甲醇的有关化学反应以及在不同温度下的化学平衡常数如下表所示:
化学反应 | 平衡常数 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g) +CO2 (g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)在恒容密闭容器中发生反应②,达到平衡后升高温度,下列说法正确的是_______。
a.平衡正向移动 b.混合气体的平均相对分子质量增大 c.CO2的转化率增大
(2)K1、K2、K3的关系是:K3=_______。
(3)500℃时测得反应在某时刻,H2(g)、CO2(g)、CH3OH(g)H2O(g)的浓度(mol/L)分别为0.2、0.1、0.01、0.2,则此时V正____V逆(填“>”“=”“<”)。
(4)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示,若开始加入2mol/LH2和1mol./LCO,则B点时化学平衡常数为___________。

(5)相同温度下,在甲、乙两个容积相等的恒容密闭容器中,投入H2和CO2,发生反应②,起始浓度如下表所示。其中甲经2min达平衡,平衡时c(H2O)=0.05mol/L,甲中CO2的转化率为_______,乙中CO2的转化率____甲。(填“大 于”、“等 于”或“小于”)
起始浓度 | 甲 | 乙 |
c(H2)/mol/L | 0.10 | 0.20 |
c(CO2 )/mol/L 0.10 | 0.20 |