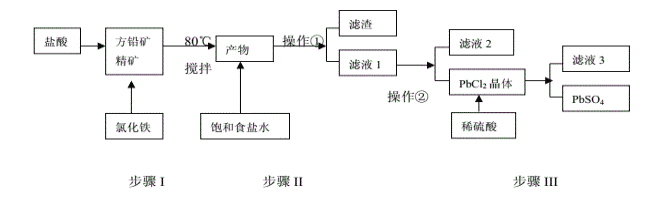
题目内容
【题目】化学与我们的生活息息相关,化学的丰富多彩从而导致我们的生活也多姿多彩。
(1)中国的瓷器名世界,制备陶瓷是以粘土[主要成分 Al2Si2O5(OH)4]为原料,经过高温烧结而成,若以氧化物形式表示该粘土的组成,则应表示为________________________。
(2)硅元素为亲氧元素,其在自然界通常以化合态形式存在,而单质硅是一种重要的半导体材料,在工业上常在高温下用C还原SiO2来制取,请写出该反应的化学方程式_________________________________。
(3)新制的氯水通入适量的SO2可以看到氯水颜色褪去,请写出此时导致颜色褪去的化学方程________。
(4)新制备的氢氧化亚铁为白色固体,在空气中会迅速变灰绿色最后变成红褐色,请写出氢氧化亚铁固体在空气中发生变化的化学方程式_______________________________________________。
(5)金属铜与浓、稀硝酸的反应可以分别用于实验室制取NO或NO2气体,请写出实验室利用铜与稀硝酸反应制取NO的离子方程式___________________________________________________。
【答案】Al2O3·2SiO2·2H2O SiO2+2C![]() Si+2CO↑ SO2+Cl2+2H2O=H2SO4+2HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Si+2CO↑ SO2+Cl2+2H2O=H2SO4+2HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
【解析】
(1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序来书写,并要遵守原子守恒来分析解答;
(2)C还原SiO2生成CO和单质硅,据此书写;
(3)二氧化硫与氯气发生氧化还原反应,导致氯水褪色;
(4)氢氧化亚铁和氧气、水反应生成氢氧化铁;
(5)Cu和稀硝酸发生氧化还原反应生成硝酸铜、NO和水。
(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序可知,Al2Si2O5(OH)4可改成Al2O3·2SiO2·2H2O;
(2)工业常用高温下C还原SiO2来制取硅,Si元素化合价降低,生成硅单质,被还原,C元素化合价升高,被氧化,生成一氧化碳,反应方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(3)二氧化硫具有还原性,能被氯水氧化,氯水褪色,反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl;
(4)氢氧化亚铁和氧气、水反应生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)硝酸具有强氧化性,能和较不活泼的金属Cu反应生成硝酸铜、NO和水,离子方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。

【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D