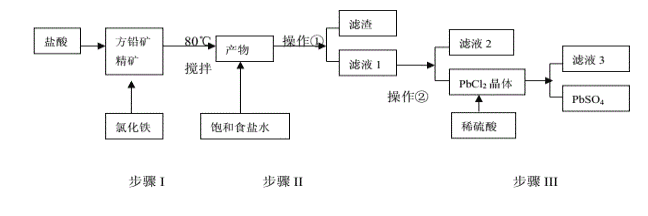
题目内容
【题目】![]() 说法正确的是( )
说法正确的是( )
A. ![]() 是氧化剂,
是氧化剂,![]() 是还原剂 B. 产物中的
是还原剂 B. 产物中的![]() 有一部分是氧化产物
有一部分是氧化产物
C. ![]() 既是氧化产物又是还原产物 D.
既是氧化产物又是还原产物 D. ![]()
![]() 发生反应,有
发生反应,有![]()
![]() 转移
转移
【答案】B
【解析】
反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4中Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,从元素化合价的角度判断并计算该题。
A.根据方程式可知反应中Cu元素化合价降低,被还原,CuSO4为氧化剂,FeS2中S元素化合价为-1价,反应后分别升高为+6价、降低为-2价,FeS2既是氧化剂又是还原剂,故A错误;
B.由化学方程式可知,反应物中含有14molSO42-离子,生成物中有17molSO42-离子,则有3molS被氧化,所以产物中SO42-有一部分是氧化产物,故B正确;
C.Cu元素化合价由+2价→+1价,S元素的化合价由-1价→-2价,所以Cu2S是还原产物,故C错误;
D.5molFeS2发生反应,Cu元素化合价由+2价→+1价,14molCuSO4得到14mol电子,FeS2→Cu2S,S元素的化合价由-1价→-2价,生成7molCu2S,得到7mol电子,有21mol电子转移,故D错误;
故答案选B。

【题目】一定条件下将质量m g的有机物在氧气中完全燃烧,燃烧后全部产物缓慢通过足量过氧化钠,充分反
应后过氧化钠固体增重n g,关于下列情况说法正确的是
有机物 | n | |
A | CH4 | 2m |
B | HCHO | 3m/2 |
C | CH3OH和CH3COOH的混合物 | 2m/3 |
D | C2H5OH和CH3COOC2H5的混合物 | m |
A. A B. B C. C D. D
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大