题目内容
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为________。
(2)EAB2D4水溶液显酸性的原因是________。
(3)将等浓度等体积的EABD3溶液和E2BD3溶液混合,所得混合溶液中各离子的离子浓度由大到小的顺序为____。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式______。
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是____。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)![]() 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5mol、A2:0.2mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将____移动(填“正向”、“逆向”或“不”)。
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5mol、A2:0.2mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将____移动(填“正向”、“逆向”或“不”)。
【答案】![]() HC2O4-的电离程度大于其水解程度,溶液中c(H+)>c(OH-),溶液显酸性c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)Ba2++HCO3-+OH-=BaCO3↓+H2O10-4:1或1:104逆向
HC2O4-的电离程度大于其水解程度,溶液中c(H+)>c(OH-),溶液显酸性c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)Ba2++HCO3-+OH-=BaCO3↓+H2O10-4:1或1:104逆向
【解析】
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,则A为氢元素;B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素;C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,则C为氮元素,X为硝酸、Y为硝酸铵;A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源,则D为氧元素、E为钠元素,据此解答。
根据以上分析可知A为H,B为C,C为N,D为O,E为Na,X为硝酸、Y为硝酸铵,则。
(1)二氧化碳是含有共价键的共价化合物,则CO2的电子式为![]() 。
。
(2)EAB2D4是NaHC2O4,H2C2O4是二元弱酸,HC2O4-既能电离又能水解,由于HC2O4-的电离程度大于其水解程度,溶液中c(H+)>c(OH-),所以溶液显酸性。
(3)EABD3和E2BD3分别是碳酸氢钠和碳酸钠,等浓度的NaHCO3和Na2CO3混合溶液中,由于CO32-的水解程度大于HCO3-的水解程度,溶液显碱性,所以溶液中各离子的离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
(4)H、C、O、Na四种元素组成的某无机化合物,受热易分解,则该物质为碳酸氢钠。碳酸氢钠溶液与足量的Ba(OH)2溶液反应生成碳酸钡、氢氧化钠和水,反应的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O。
(5)常温下,测得硝酸和硝酸铵的水溶液的pH均为5,硝酸抑制水的电离而硝酸铵水解促进水的电离,则硝酸中水电离的H+浓度等于c(OH-)=10-9mol/L,硝酸铵中水电离的H+浓度等于c(H+)=10-5mol/L,所以两种水溶液中由水电离出的H+浓度之比是10-4:1或1:104。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为N2是0.5mol、H2是0.2mol、NH3是0.2 mol,气体的总物质的量为0.9mol,此时容器体积为1.0 L,则平衡常数K=
2NH3(g)ΔH=-92.4 kJ·mo1-1。反应达到平衡后,测得容器中各物质的物质的量分别为N2是0.5mol、H2是0.2mol、NH3是0.2 mol,气体的总物质的量为0.9mol,此时容器体积为1.0 L,则平衡常数K=![]() 。如果保持温度和压强不变,向上述平衡体系中加入0.18mol N2,若平衡不移动,则气体的总物质的量变为(0.9mol+0.18mol)=1.08mol,容器的体积变为
。如果保持温度和压强不变,向上述平衡体系中加入0.18mol N2,若平衡不移动,则气体的总物质的量变为(0.9mol+0.18mol)=1.08mol,容器的体积变为![]() ,此时浓度熵Qc=
,此时浓度熵Qc=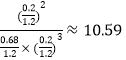 >10,所以平衡将逆向移动。
>10,所以平衡将逆向移动。

 优学名师名题系列答案
优学名师名题系列答案【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大