题目内容
【题目】氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0,第3.00 min时体系压强为P1,则P1:P0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O5 ) d.气体的平均相对分子质量为43.2,且保持不变
(3)将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:
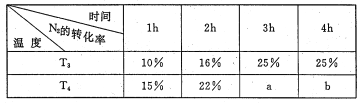
表中a、b、25%三者由大到小的顺序为_____,理由是_____。
(4)将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶液呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
【答案】 2NO(g)+ 2CO(g)![]() N2(g)+2CO2(g) △H =-746.5kJ·mol-1 1.975:1 0.055 mol·L-1·min-1 ab 25%>a=b 升高温度,化学反应速率加快,在小于3h时已达平衡,故a=b。又因该反应正向放热,升温平衡逆向移动N2 的转化率下降,故25%>a=b 1.8×10-5mol/L
N2(g)+2CO2(g) △H =-746.5kJ·mol-1 1.975:1 0.055 mol·L-1·min-1 ab 25%>a=b 升高温度,化学反应速率加快,在小于3h时已达平衡,故a=b。又因该反应正向放热,升温平衡逆向移动N2 的转化率下降,故25%>a=b 1.8×10-5mol/L
【解析】(1)根据平衡常数可得反应方程式④:2NO(g)+2CO(g)N2(g)+2CO2(g),将上述三个已知方程式依次编号为①、②、③,根据盖斯定律可知④=②×2③①,则有2NO(g)+2CO(g)N2(g)+2CO2(g) △H=746.5kJ/mol;
(2)①同温同压下,气体的物质的量之比等于压强之比;根据已知条件列出三段式:

反应前后气体的压强之比等于物质的量之比,所以p1:p0=(0.35+1.30+0.325) : 1=1.975 : 1;
2min~5min内,△c(N2O5)=(0.50-0.17)mol/L=0.33mol/L,同一时段内,各物质浓度变化量之比等于计量系数之比,则△c(O2)=0.165mol/L,所以v(O2)= ![]() =0.055mol/(L·min)。
=0.055mol/(L·min)。
故答案为:1.975:1 ;0.055 mol·L-1·min-1 ;
②变量不变达平衡。a、NO2和O2的浓度在平衡前是一个变量,当浓度不再改变的时候,说明反应达到平衡状态,故a正确;b、恒温恒容时,压强与气体的总物质的量成正比,该反应气体的总物质的量是变量,则压强也是变量,当压强不变时,反应达到平衡,故b正确;c、v正(NO2)=2v逆(N2O5)时才能说明反应达到平衡,故c错误;d、该反应气体的总质量不变,若反应向右进行,气体的总物质的量增大,气体的平均相对分子质量减小,当气体的平均相对分子质量不再改变时,则反应达到平衡状态;若N2O5分解彻底,容器中气体只有NO2与O2,且NO2与O2的物质的量之比为4:1,气体的平均相对分子质量=![]() =43.2,但该反应为可逆反应,不能进行彻底,所以平衡时气体的平均相对分子质量应大于43.2,故d 错误。故选ab。
=43.2,但该反应为可逆反应,不能进行彻底,所以平衡时气体的平均相对分子质量应大于43.2,故d 错误。故选ab。
(3)根据表格数据可知,T3和T4条件下,0~1h 时段,反应未达到平衡,此时温度温度越高,反应越快,N2的转化率越大。1h内,T4时N2的转化率高于T3,则温度T4>T3。由表格数据可知,T3温度下,反应在3h时已处于平衡状态,温度越高,反应先达到平衡,所以T3温度下,反应在3h时也已经处于平衡状态,所以有a=b。又N2(g)+3H2(g) 2NH3(g) △H<0,该反应正反应为放热反应,升高温度,平衡左移,则温度越高反应物的平衡转化率越低,所以a<25%,所以有25%>a=b。
故答案为:25%>a=b;升高温度,化学反应速率加快,在小于3h时已达平衡,故a=b。又因该反应正向放热,升温平衡逆向移动N2的转化率下降,故25%>a=b。
(4)CH3COONH4溶液呈中性,则CH3COO-的水解程度等于NH4+的水解程度,所以,一定温度下CH3COOH的电离常数Ka等于NH3·H2O的电离平衡常数Kb。25℃时0.18mol/LCH3COOH溶液中c(H+)=1.8×10-3mol/L ,则CH3COOH的电离常数Ka=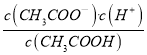 ≈
≈ =1.8×10-5mol/L。故25℃时NH3·H2O的电离常数Kb等于1.8×10-5mol/L。
=1.8×10-5mol/L。故25℃时NH3·H2O的电离常数Kb等于1.8×10-5mol/L。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】氧化亚铜(Cu2O)是船舶防污剂的首选,可利用印刷电路板酸性蚀刻液(CuCl42-、Cl-、H+)和碱性蚀刻液[Cu(NH3)42+、NH4+、NH3、Cl-]来制备,工艺流程如下:
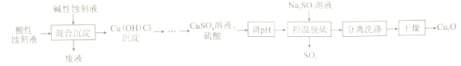
已知:强酸条件下,2Cu+==Cu+Cu2+
(1)不同pH下“混合沉淀”实验结果见下表。由表可知,pH应控制在______左右。
pH | 4.00 | 4.50 | 5.40 | 6.20 | 6.50 | 7.00 | 8.00 | 8.50 |
废液含铜量/g.L-1 | 19.5 | 2.4 | 2.0 | 0.3 | 0.2 | 2.0 | 8.3 | 17.0 |
(2)“混合沉淀”中废液的主要成分为______________(填化学式)
(3)“控温脱硫”生成Cu2O的离子方程式为_________;该过程产生的SO2经_____(填化学式)处理后生成可循环物质Na2SO3。
(4)“控温脱硫”过程中温度对Cu2O的产率影响及SO2在水中溶解度随温度变化如图所示:

下列说法正确的是_____
a.在60℃以下,温度越高,SO2越易逸出,有利于提高生产中硫原子利用率
b.反应温度的变化是影响Cu2O产率的主要因素
c.结合工业生产实际,温度应控制在溶液呈沸腾状态
d.低温时,Cu2O产率较低与SO2低温时的溶解度较大有关
(5)检验Cu2O是否洗涤干净的方法是______________________________。
(6)某工厂用V1,L含铜量120g·L-1的酸性蚀刻液和V2L含铜量160g·L-1的碱性蚀刻液制备Cu2O,最终得到产品mg,产率为____%。