��Ŀ����
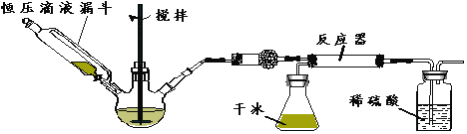
����Ŀ������������H2C2O4��ʾ��Ϊ�˲ⶨij������Һ��Ũ�ȣ���������ʵ�飺��ȡWg���ᾧ�壬���100.00mLˮ��Һ��ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��ΪamolL��1��KMnO4��Һ�ζ���KMnO4������ɫΪֹ���������ķ�ӦΪ��2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2��+2MnSO4+8H2O��
�Իش�
��1��ʵ���У���ҺKMnO4��ҺӦװ��ʽ�ζ����У���Ϊ ��
��2��ʵ�����۾�ע�� �� ֱ���ζ��յ㣮�жϵ����յ�������� ��
��3��ʵ���У����в�����������������ȷ��������������Ũ����ʲôӰ�죿����ƫ��ƫС����Ӱ�죩
A. �ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶� ��
B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ ��
C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���� ��
���𰸡�
��1���������ؾ���ǿ������
��2����ƿ����ɫ�仯����ƿ����Һ��ɫǡ������ɫ��Ϊ�Ϻ�ɫ���Ұ��������ɫ���ָ�
��3��ƫС����Ӱ�죻ƫС
����������1�����������Һ��ǿ�����ԣ�Ӧʢװ����ʽ�ζ����У���2���ζ�ʱ�����ֿ��ƻ���������ҡ����ƿ���۾���ƿ����ɫ�仯���ж��յ㣺�����һ�μ���ʱ����ƿ����Һ��ɫǡ������ɫ��Ϊ�Ϻ�ɫ���Ұ��������ɫ���ָ�����3������ ![]() ������֪��A.�ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶ȵ���V(��)��С����c(����)ƫС��B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ����c(����)��Ӱ�죻C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���֣�����n(H2C2O4)��С����ζ�����n(KMnO4)��С����V(��)��С����c(����)ƫС��
������֪��A.�ζ�ǰ���ӿ̶ȣ��ζ����ӿ̶ȵ���V(��)��С����c(����)ƫС��B. ��ƿ��ʢ�Ŵ���Һǰδ�������������ˮ����c(����)��Ӱ�죻C. �ζ�������ҡ����ƿ��������ƿ�ڵ���Һ����һ���֣�����n(H2C2O4)��С����ζ�����n(KMnO4)��С����V(��)��С����c(����)ƫС��
�����㾫����������Ĺؼ�������������к͵ζ������֪ʶ�������к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ㣮

����Ŀ�������仯�����ڹ�ũҵ����������������ҪӦ�ã����ٵ����������ڴ����е��ŷ��ǻ�����������Ҫ����֮һ��
��1����֪:N2(g)+O2(g)==2NO(g) ��H =+180.5kJ��mol-1
C(s)+O2(g)=CO2(g) ��H =-393.5kJ��mol-1
2C(s)+O2(g)=2CO(g) ��H =-221kJ��mol-1
��ij��Ӧ��ƽ�ⳣ������ʽΪ��k=[c(N2)��c2(CO2)]/[c2(NO)��c(CO)]����д���˷�Ӧ���Ȼ�ѧ����ʽ_______��
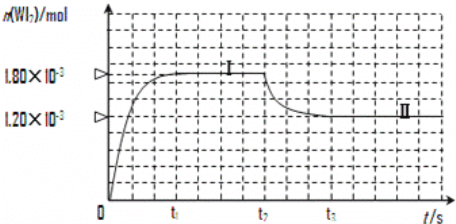
��2��N2O5��һ�������¿ɷ����ֽ�:2N2O5(g)![]() 4NO2(g)+O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���:
4NO2(g)+O2(g)��ij�¶��²�ú����ܱ�������N2O5Ũ����ʱ��ı仯���:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
�ٷ�Ӧ��ʼʱ��ϵѹǿΪP0����3.00 minʱ��ϵѹǿΪP1����P1:P0=_______��2min~5.00min �ڣ�O2 �� ƽ ����Ӧ����Ϊ_____________��
��һ���¶��£��ں����ܱ������г���һ����N2O5���и÷�Ӧ�����жϷ�Ӧ�Ѵﵽ��ѧƽ��״̬����___��
a.NO2 ��O2 ��Ũ�ȱȱ��ֲ��� b.������ѹǿ���ٱ仯
c.2v��(NO2)= v��(N2 O5 ) d.�����ƽ����Է�������Ϊ43.2���ұ��ֲ���
��3����2molN2 ��4mo1H2 ����lL�ĺ����ܱ������з�Ӧ����ò�ͬ�¶ȡ���ͬʱ����ںϳ�NH3 ��Ӧ��N2 ��ת���ʣ��õ��������±�:

����a��b��25%�����ɴ�С��˳��Ϊ_____��������_____��
��4������3����ʵ��õ��Ļ������ͨ�������Һ�в��ָ���25�棬������ǡ�÷�Ӧʱ�����ɵ�CH3COONH4��Һ�����ԣ���25��ʱNH3��H2O�ĵ���ƽ�ⳣ��Kb=______(��֪:25��ʱ0.18mol/LCH3COOH ��Һ��c(H+)=1.8��10-3mol/L)��