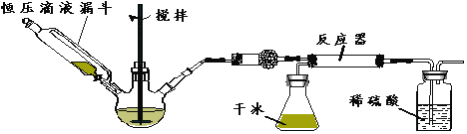
题目内容
【题目】如表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
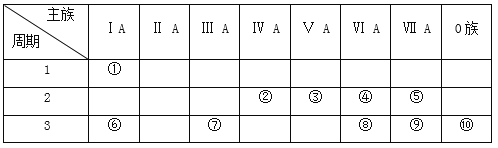
(1)在上述元素最高价氧化物对应水化物中,酸性最强的是_______________,碱性最强的是_____________,显两性的是_____________。(化学式)
(2)这些元素中,化学性质最不活泼原子的原子结构示意图为__________;气态氢化物中,最稳定的是_________(化学式),②③④⑤形成的氢化物中沸点最高的是_______(化学式)。
(3)①和④两种元素的原子按1:1组成的常见化合物的电子式为_____________。
(4)④、⑥、⑦、⑨的简单离子半径由大到小的顺序为______________________________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式_____________________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是_______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
【答案】 HClO4 NaOH Al(OH)3 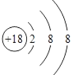 HF H2O
HF H2O ![]() Cl- > O2- > Na+ > Al3+ NaOH + Al(OH)3 = NaAlO2 + H2O BC
Cl- > O2- > Na+ > Al3+ NaOH + Al(OH)3 = NaAlO2 + H2O BC
【解析】根据元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是S,⑨是Cl,⑩是Ar。第三周期,从左向右金属性在减弱,非金属性增强,Cl的非金属性最强,钠的金属性最强,铝具有两性;可利用两种金属分别与水、酸反应的剧烈程度,金属之间的置换反应,最高价氧化物对应水化物的碱性等来判断。
(1)第三周期,从左向右金属性在减弱,非金属性增强,Cl的非金属性最强,钠的金属性最强,铝具有两性;在上述元素最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是NaOH,显两性的是Al(OH)3 。(2)这些元素中,Ar是惰性元素,化学性质最不活泼原子是Ar,原子结构示意图为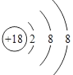 ;F的非金属性最强,气态氢化物中,最稳定的是HF,②③④⑤形成的氢化物中,水分子间形成氢键,沸点最高的是H2O(化学式)。(3)①为H和④为O,两种元素的原子按1:1组成的常见化合物的电子式为
;F的非金属性最强,气态氢化物中,最稳定的是HF,②③④⑤形成的氢化物中,水分子间形成氢键,沸点最高的是H2O(化学式)。(3)①为H和④为O,两种元素的原子按1:1组成的常见化合物的电子式为![]() 。(4)④、⑥、⑦、⑨的简单离子半径,氯离子三个电子层,半径最大,O2- 、Na+ 、 Al3+三种离子电子层结构相同,核电荷大的半径小,由大到小的顺序为Cl- > O2- > Na+ > Al3+ 。(5)⑥和⑦的最高价氧化物对应水化物是 NaOH 、Al(OH)3 ,两者反应生成 NaAlO2 、 H2O ,两者之间发生反应的化学方程式 NaOH + Al(OH)3 = NaAlO2 + H2O 。(6)为了证明⑥和⑦两种元素的金属性强弱,A.比较两种元素的单质的熔点、沸点高低,不能确定金属性强弱,故A错误;B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度,反应剧烈的金属性强,故B正确;C.比较两种元素的最高价氧化物对应的水化物的碱性强弱,碱性越强,金属性越强,故C正确;故选BC。
。(4)④、⑥、⑦、⑨的简单离子半径,氯离子三个电子层,半径最大,O2- 、Na+ 、 Al3+三种离子电子层结构相同,核电荷大的半径小,由大到小的顺序为Cl- > O2- > Na+ > Al3+ 。(5)⑥和⑦的最高价氧化物对应水化物是 NaOH 、Al(OH)3 ,两者反应生成 NaAlO2 、 H2O ,两者之间发生反应的化学方程式 NaOH + Al(OH)3 = NaAlO2 + H2O 。(6)为了证明⑥和⑦两种元素的金属性强弱,A.比较两种元素的单质的熔点、沸点高低,不能确定金属性强弱,故A错误;B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度,反应剧烈的金属性强,故B正确;C.比较两种元素的最高价氧化物对应的水化物的碱性强弱,碱性越强,金属性越强,故C正确;故选BC。

【题目】氮及其化合物在工农业生产生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H =-221kJ·mol-1
若某反应的平衡常数表达式为:k=[c(N2)·c2(CO2)]/[c2(NO)·c(CO)],请写出此反应的热化学方程式_______。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
4NO2(g)+O2(g),某温度下测得恒容密闭容器中N2O5浓度随时间的变化如表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
C(N2O6)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0,第3.00 min时体系压强为P1,则P1:P0=_______;2min~5.00min 内,O2 的 平 均反应速率为_____________。
②一定温度下,在恒容密闭容器中充人一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是___。
a.NO2 和O2 的浓度比保持不变 b.容器中压强不再变化
c.2v正(NO2)= v逆(N2 O5 ) d.气体的平均相对分子质量为43.2,且保持不变
(3)将2molN2 和4mo1H2 置于lL的恒容密闭容器中反应。测得不同温度、不同时间段内合成NH3 反应中N2 的转化率,得到数据如下表:

表中a、b、25%三者由大到小的顺序为_____,理由是_____。
(4)将(3)中实验得到的混合气体通入醋酸溶液中并恢复到25℃,当两者恰好反应时,生成的CH3COONH4溶液呈中性,则25℃时NH3·H2O的电离平衡常数Kb=______(已知:25℃时0.18mol/LCH3COOH 溶液中c(H+)=1.8×10-3mol/L)。
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是。
(2)该温度下,该反应的化学平衡常数是。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是。此时,该合成反应是否达到了平衡状态?(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。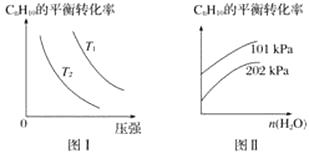
①由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是。