题目内容
【题目】I.用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
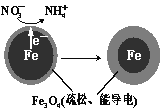
正极的电极反应式是 。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ.Fe2+破坏FeO(OH)氧化层。
① 对比实验,结果如图所示,可得到的结论是 。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3-去除率的原因: 。
II.高铁酸钠Na2FeO4 是一种新型净水剂。
(4)高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH= 2Na2FeO4+3X+5H2O,则X的化学式为__________。
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体能够吸附水中悬浮杂质,请写出高铁酸钠与水反应的离子方程式 。
【答案】
(1)NO3+8e-+10H+=NH4++3H2O;
(2)FeO(OH)不导电,阻碍电子转移
(3)①本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率
②Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移
(4)①NaCl;
(5)4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2。
【解析】
试题分析:(1)Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3-的去除率低.故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从图2的实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率,故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移,故答案为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移;
(4)因为反应前后各元素原子个数相等,X的化学式为NaCl,故答案为:NaCl;
(5)高铁酸钠具有强氧化性,与水反应生成Fe(OH)3胶体,反应的离子方程式为, 4FeO42-+10H2O= 4Fe(OH)3+8OH-+3O2。