��Ŀ����
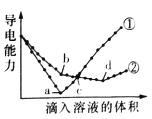
����Ŀ����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
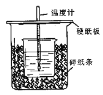
(1)��ϸ�۲�ʵ��װ�ã�ͼ���Ƿ�ȱ��һ�ֲ�����Ʒ�����ȱ�٣�ȱ�ٵ��� (���������ƣ������ȱ�٣��˿ղ��)��ͼ���Ƿ��в���֮�����������ָ�� (���û�У��˿ղ��)
(2)�ձ���������ֽ���������� ��
(3)���ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
(4)����ͬŨ�Ⱥ�����Ĵ������������Һ��������ʵ�飬��õ��к�����H�� ��(����ƫ��������ƫС��������Ӱ����)��
(5)�����60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)����������
���𰸡�
(1)���β�������� �����ձ���С�ձ��ڲ�ƽ
(2)���� ������ʵ������������ʧ��
(3)ƫС ��(4)ƫ��
(5)����ȡ���ȡ��к�����һ����ֵ����ʵ�������������
��������
���������(1)�������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β����������װ�õĴ����ǣ�С�ձ�������ձ��ڲ���ƽ����δ������ֽ�����ʴ�Ϊ�����β�����������ڴ�С�ձ���δ������ֽ����С�ձ�������ձ��ڲ���ƽ��
(2)�к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹������ձ���������ֽ���������DZ��¡����ȣ�����ʵ������е�������ʧ���ʴ�Ϊ�����¡����ȣ�����ʵ������е�������ʧ��
(3)���ձ����粻��Ӳֽ�壬���������ʧ����õ��к�����ֵ�����С���ʴ�Ϊ��ƫС��
(4)����Ϊ���ᣬ�������Ϊ���ȹ��̣������ô������ϡ������Һ��Ӧ����Ӧ�ų�������ƫС����õ��к�����ֵ�����С����H��ƫ�ʴ�Ϊ��ƫ��
(5)��Ӧ�ų����������������Լ�������Ķ����йأ���60mL 0.50mol/L������50mL 0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ��к�����ֵ��ȣ��ʴ�Ϊ������ȣ���ȣ��к�����ָ�������кͷ�Ӧ����1molˮ���ų�������Ϊ���ģ������ᡢ��������ء�

 ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�