题目内容
氟化硅(SiF4)是有毒的无色气体,可用于水泥和人造大理石的硬化剂等.制取氟化硅(SiF4)的化学方程式为:2CaF2+2H2SO4+SiO2
2CaSO4+SiF4↑+2H2O.
(1)CaF2又名“萤石”,属于 晶体.在上述反应的反应物和生成物中,属于非极性分子的结构式为 .
(2)反应物中有三种元素在元素周期表中处于相邻位置,比较三种元素简单离子的半径由大到小的顺序为 (用“r”及离子符号表示).
(3)氟化硅在潮湿的空气中因水解而产生硅酸(H2SiO3)和大量酸雾,用化学方程式说明在制备和收集氟化硅时不能使用玻璃仪器的原因是(用化学方程式表示): ; .
| ||
(1)CaF2又名“萤石”,属于
(2)反应物中有三种元素在元素周期表中处于相邻位置,比较三种元素简单离子的半径由大到小的顺序为
(3)氟化硅在潮湿的空气中因水解而产生硅酸(H2SiO3)和大量酸雾,用化学方程式说明在制备和收集氟化硅时不能使用玻璃仪器的原因是(用化学方程式表示):
考点:含硅矿物及材料的应用,元素周期律的作用
专题:碳族元素
分析:(1)活泼金属与活泼非金属形成离子化合物;
SiF4是非极性分子,Si原子与F原子之间形成1对共用电子对;
(2)反应物中有三种元素在元素周期表中处于相邻,则该三种元素是O、F、S,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
(3)根据题干信息和原子守恒推出大量酸雾为HF,根据玻璃仪器的主要成分分析.
SiF4是非极性分子,Si原子与F原子之间形成1对共用电子对;
(2)反应物中有三种元素在元素周期表中处于相邻,则该三种元素是O、F、S,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
(3)根据题干信息和原子守恒推出大量酸雾为HF,根据玻璃仪器的主要成分分析.
解答:
解:(1)CaF2属于离子晶体,SiF4是非极性分子,Si原子与F原子之间形成1对共用电子对,结构式为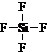 ,
,
故答案为:离子;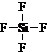 ;
;
(2)反应物中有三种元素在元素周期表中处于相邻,则该三种元素是O、F、S,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径S2->O2->F-,
故答案为:r(S2-)>r(O2-)>r(F-);
(3)氟化硅在潮湿的空气中因水解而产生硅酸(H2SiO3)和大量酸雾,根据质量守恒定律可知,反应前后元素的种类、原子的种类和个数不变,氢原子、氟原子的个数前后相等,所以大量酸雾为HF,发生的反应为:SiF4+3H2O═H2SiO3+4HF↑,氢氟酸与玻璃中的二氧化硅反应4HF+SiO2═SiF4↑+2H2O生成水和四氟化硅,所以在制备和收集氟化硅时不能使用玻璃仪器,
故答案为:SiF4+3H2O═H2SiO3+4HF↑;4HF+SiO2═SiF4↑+2H2O.
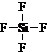 ,
,故答案为:离子;
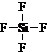 ;
;(2)反应物中有三种元素在元素周期表中处于相邻,则该三种元素是O、F、S,电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径S2->O2->F-,
故答案为:r(S2-)>r(O2-)>r(F-);
(3)氟化硅在潮湿的空气中因水解而产生硅酸(H2SiO3)和大量酸雾,根据质量守恒定律可知,反应前后元素的种类、原子的种类和个数不变,氢原子、氟原子的个数前后相等,所以大量酸雾为HF,发生的反应为:SiF4+3H2O═H2SiO3+4HF↑,氢氟酸与玻璃中的二氧化硅反应4HF+SiO2═SiF4↑+2H2O生成水和四氟化硅,所以在制备和收集氟化硅时不能使用玻璃仪器,
故答案为:SiF4+3H2O═H2SiO3+4HF↑;4HF+SiO2═SiF4↑+2H2O.
点评:本题考查常用化学用语书写、半径比较等,是对基础知识的简单利用,难度不大,注意对基础知识的全面掌握.注意氢氟酸与玻璃中的二氧化硅反应原理,为高频考点.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
在BaCl2溶液中通入足量SO2气体溶液仍澄清,此澄清溶液通入下列气体仍无明显现象的是( )
| A、NO2 |
| B、Cl2 |
| C、NH3 |
| D、CO2 |
下列说法正确的是( )
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |
下列化学用语表述正确的是( )
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
化学与社会生活密切相关,下列说法正确的是( )
| A、维勒打破了无机物和有机物的界限,汤姆生提出了带核的原子结构模型 |
| B、甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料 |
| C、“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关 |
| D、有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小有磁性,这种碳与金刚石的关系是同素异形体 |
 ;则机理b是
;则机理b是
 b.
b. c.
c.
 氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题:
氮的固定是指将氮元素由游离态转化为化合态的过程.据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol.回答下列问题: