题目内容
4.下列各组原子中,彼此化学性质一定相似的是( )| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式的1s22s2的Y原子 | |
| B. | 原子核外L层仅有两个电子的X原子与原子核外M层仅有两个电子的Y原子 | |
| C. | 2p轨道只有一个未成对电子的X原子和3P轨道只有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
分析 A.原子核外电子排布式为1s2为He,原子核外电子排布式为1s22s2为Be;
B.原子核外L层上仅有两个电子的X为Be元素,原子核外M层上仅有两个电子的Y为Mg元素;
C.2p轨道只有一个未成对电子的X为B元素或F元素,3P轨道只有一个未成对电子的Y为Al或Cl元素;
D.最外层都只有一个电子的X、Y原子,可能为H与碱金属元素.
解答 解:A.原子核外电子排布式为1s2为He,原子核外电子排布式为1s22s2为Be,二者性质不同,故A错误;
B.原子核外L层上仅有两个电子的X为Be元素,原子核外M层上仅有两个电子的Y为Mg元素,二者属于同主族的金属元素,其化学性质相似,故B正确;
C.2p轨道只有一个未成对电子的X为B元素或F元素,3P轨道只有一个未成对电子的Y为Al或Cl元素,如果X为F,Y为Al,则二者的性质不相似,故C错误;
D.最外层都只有一个电子的X、Y原子,可能为H与碱金属元素,性质有相似地方,都具有还原性,但与ⅠB族元素性质不同,虽然最外层也有1个电子,故D错误;
故选B.
点评 本题考查原子的结构和元素的性质,题目难度不大,注意原子核外电子排布特点与对应元素化合物的性质的关系.

练习册系列答案
相关题目
14.为了除去CO2中含有少量的SO2气体,可以使气体通过( )
| A. | Na2CO3溶液 | B. | H2SO4溶液 | C. | NaHCO3溶液 | D. | Ba(OH)2溶液 |
15.下列说法正确的是( )
| A. | HCl比H2S稳定 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 离子键的本质是带相反电荷的阴、阳离子的相互吸引 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
12.航天飞船可用肼(电子式为 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )| A. | 该动力源的突出优点之一是反应产物对环境无污染 | |
| B. | 液态肼燃烧生成1 mol N2时放出的热量为20.05 kJ | |
| C. | 该反应中肼作氧化剂 | |
| D. | 肼和过氧化氢中的化学键类型相同 |
19.具有下列电子排布式的原子中,半径最大的是( )
| A. | 1s22s22p3 | B. | ls22s22p63s23p1 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
9.下列有关化学用语使用正确的是( )
| A. | 乙烯的结构式为:CH2CH2 | |
| B. | NH4C1的电子式: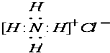 | |
| C. | Cr原子 的基态简化电子排布式为[Ar]3d54s1 | |
| D. | S原子的价电子轨道表示式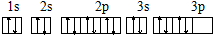 |
13.分子式为C6H12O2,属于乙酸乙酯同系物的同分异构体共有( )
| A. | 12种 | B. | 16种 | C. | 20种 | D. | 24种 |
14.科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2$?_{释氢}^{储氢}$HCOONa+H2O.下列有关说法正确的是( )
| A. | 储氢、释氢过程均无能量变化 | |
| B. | NaHCO3只含离子键 | |
| C. | 储氢过程中,NaHCO3被还原 | |
| D. | 释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
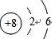 .
.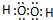 ,化合物XYZ的结构式
,化合物XYZ的结构式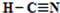 .
.