题目内容
4.8g CH4中约含有3.01×1023个分子、含有5mol电子,在标准状况下所占的体积约为11.2L.分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$结合物质的构成计算该题.
解答 解:n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,N(CH4)=0.5mol×6.02×1023/mol=3.01×1023,含有的电子的物质的量为0.5mol×10=5mol,V(CH4)=0.5mol×22.4L/mol=11.2L,
故答案为:3.01×1023;5;11.2.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点以及相关计算公式的运用,难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
15.2.8gFe全部溶于一定浓度200mLHNO3溶液中,得到标准状况下气体1.12L,测得反应后溶液pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是( )
| A. | 反应后溶液中铁元素一定只以Fe3+形式存在 | |
| B. | 1.12L气体可能是NO、NO2的混合气体 | |
| C. | 反应后溶液中c(NO3-)=0.85mol/L | |
| D. | 反应后的溶液最多还能溶解1.82gFe |
13.下列各组离子可能大量共存的是( )
| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol•L-1的溶液中Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol•L-1AlCl3溶液中可能大量存在[Al(OH)4]-、K+、CO32- |

 、
、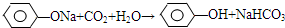 .
.