题目内容
13.下列各组离子可能大量共存的是( )| A. | 与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol•L-1的溶液中Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol•L-1AlCl3溶液中可能大量存在[Al(OH)4]-、K+、CO32- |
分析 A.与铝反应放出氢气的溶液呈强碱性或为非氧化性酸溶液;
B.常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液呈酸性;
C.水电离出的c(H+)=10-10mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性;
D.与Al3+反应的离子不能大量共存.
解答 解:A.与铝反应放出氢气的溶液呈强碱性或为非氧化性酸溶液,如在碱性条件下,离子之间不发生任何反应,可大量共存,故A正确;
B.常温下$\frac{{k}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液呈酸性,酸性条件下,Fe2+、NO3-发生氧化还原反应不能大量共存,故B错误;
C.水电离出的c(H+)=10-10mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故C错误;
D.[Al(OH)4]-、CO32-与Al3+发生互促水解反应而不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存问题,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,明确信息得出溶液的酸碱性是解答本题的关键,并注意离子之间的氧化还原反应来解答,题目难度中等.

练习册系列答案
相关题目
3.1gH2中含有原子数目( )
| A. | 0.5 mol | B. | 1 mol | C. | 1.5 mol | D. | 2 mol |
1.下列实验操作中错误的是( )
| A. | 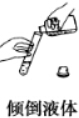 | B. | 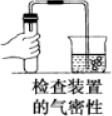 | C. | 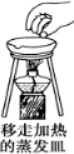 | D. | 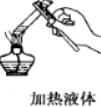 |
5.化学在生产和日常生活中有着重要的作用.下列说法中不正确的是( )
| A. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况 | |
| D. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 |
12.用含有A1203、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:除去铁元素
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是浓盐酸与MnO2加热生成黄绿色气体Cl2即可判断MnO2是否存在.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:除去铁元素
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是浓盐酸与MnO2加热生成黄绿色气体Cl2即可判断MnO2是否存在.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题: 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: