题目内容
3.某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2SO2+O2?2SO3反应.几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90%,则该反应达到平衡时SO2的转化率为33.3%.分析 设平衡时转化的二氧化硫为xmol,则:
2 SO2(g)+O2(g)?2 SO3(g)
起始量(mol):0.3 0.2 0
变化量(mol):x 0.5x x
平衡量(mol):0.3-x 0.2-0.5x x
根据压强之比等于物质的量之比,则0.3-x+0.2-0.5x+x=90%×(0.3+0.2),进而计算二氧化硫转化率.
解答 解:设平衡时转化的二氧化硫为xmol,则:
2 SO2(g)+O2(g)?2 SO3(g)
起始量(mol):0.3 0.2 0
变化量(mol):x 0.5x x
平衡量(mol):0.3-x 0.2-0.5x x
压强之比等于物质的量之比,则0.3-x+0.2-0.5x+x=90%×(0.3+0.2),解得x=0.1,则二氧化硫转化率为$\frac{0.1mol}{0.3mol}$×100%=33.3%,
故答案为:33.3%
点评 本题考查化学平衡计算,比较基础,注意三段式均摊法应用,有利于基础知识的巩固.

练习册系列答案
相关题目
5.化学在生产和日常生活中有着重要的作用.下列说法中不正确的是( )
| A. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况 | |
| D. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 |
8.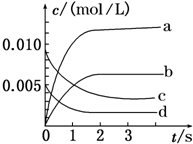 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
(1)在第4s时,X的转化率为多少?
(2)如图中表示Z变化曲线的是b,用Y表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
 在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )
在2L密闭容器内,800℃时X(g)和Y(g)反应生成Z(g)的体系中,n(X)随时间的变化如表所示:(已知:2X(g)+Y(g)?2Z(g) )| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(X)/mol | 0.020 | 0.010 | 0.008 | 0.008 | 0.008 | 0.008 |
(2)如图中表示Z变化曲线的是b,用Y表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
12.用含有A1203、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:除去铁元素
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是浓盐酸与MnO2加热生成黄绿色气体Cl2即可判断MnO2是否存在.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:除去铁元素
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是浓盐酸与MnO2加热生成黄绿色气体Cl2即可判断MnO2是否存在.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
13.下列对有关实验操作的叙述错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配置一定物质的量浓度溶液转移操作时玻璃棒下端抵在容量瓶刻度线处 |
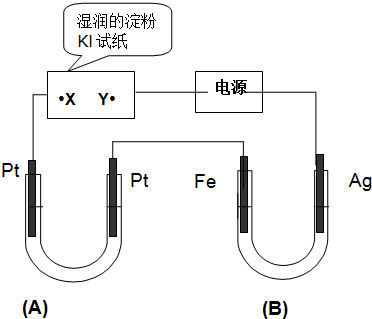
 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: