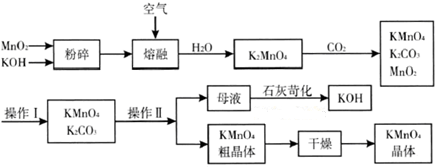
题目内容
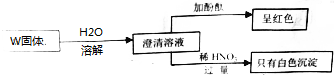
6.废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3,的流程图如下.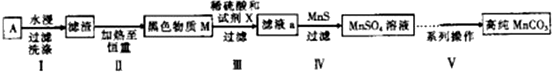
(1)碱性锌锰干电池的负极材料是Zn(填化学式).
(2)第Ⅱ步操作的目的是除去碳粉.
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为Zn2++MnS=ZnS+Mn2+.(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5g 黑色物质M进行制备MnSO3的实验,得到数据如下表:
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为MnO2+H2O2+H2SO4=MnSO4+2H2O+O2↑.
(5)已知:MaCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂:NaHCO3、乙醇)
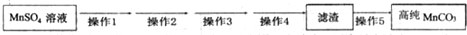
操作1:加入NaHCO3,控制pH<7.7;
操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干.
(6)操作1可能发生反应的离子方程式Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.
分析 (1)碱性锌锰干电池中失电子的为负极;
(2)MnO2和碳粉均不能溶于水,除去碳粉可以加热;
(3)根据沉淀的转化分析;
(4)①根据表中数据可知用30%过氧化氢生成的MnSO4最多;
②在酸性条件下30%过氧化氢与MnO2反应生成MnSO4,根据原子守恒和电子守恒分析;
(5)MnSO4溶液操作1为加入碳酸氢钠溶液,生成MnCO3沉淀;过滤,用少量水洗涤2~3次;然后检验是否洗涤干净;由于MaCO3难溶于水和乙醇,潮湿时易被空气氧化,再用少量乙醇洗涤滤渣;低温烘干得到纯净的MnCO3;
操作1:加入NaHCO3调节pH,不能生成Mn(OH)2沉淀;
操作4:MaCO3难溶于水和乙醇,潮湿时易被空气氧化,所以用无水乙醇洗涤;
(6)硫酸锰与NaHCO3反应生成碳酸锰和二氧化碳.
解答 解:(1)碱性锌锰干电池中失电子的为负极,则锌为负极,故答案为:Zn;
(2)MnO2和碳粉均不能溶于水,过滤得到的滤渣为MnO2和碳粉,除去碳粉可以加热,所以第Ⅱ步操作加热的目的是除去碳粉,故答案为:除去碳粉;
(3)已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24,MnS可以转化为ZnS,所以除去Zn2+可以用MnS,其离子方程式为:Zn2++MnS=ZnS+Mn2+;
故答案为:Zn2++MnS=ZnS+Mn2+;
(4)①根据表中数据可知用30%过氧化氢生成的MnSO4最多,所以试剂x的最佳选择是30%过氧化氢;故答案为:30%过氧化氢;
②在酸性条件下30%过氧化氢与MnO2反应生成MnSO4,H2O2中O元素的化合价升高生成O2,其反应的离子方程式为:MnO2+H2O2+H2SO4=MnSO4+2H2O+O2↑;
故答案为:MnO2+H2O2+H2SO4=MnSO4+2H2O+O2↑;
(5)MnSO4溶液中加入碳酸氢钠溶液,生成MnCO3沉淀;过滤,用少量水洗涤沉淀2~3次;然后检验是否洗涤干净;由于MaCO3难溶于水和乙醇,潮湿时易被空气氧化,再用少量乙醇洗涤滤渣;最后低温烘干得到纯净的MnCO3;
操作1:若要把MnSO4转化为MnCO3,要加入NaHCO3,pH应该小于7.7,防止生成Mn(OH)2沉淀,故答案为:加入NaHCO3,控制pH<7.7;
操作4:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,则洗涤沉淀时不能用水,所以用无水乙醇洗涤,故答案为:用少量无水乙醇洗涤2~3次;
(6)硫酸锰与NaHCO3反应生成碳酸锰和二氧化碳,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑,故答案为:Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.
点评 本题考查了物质的分离提纯实验操作,涉及原电池原理、物质的分离、沉淀的转化、氧化还原反应、洗涤操作等,题目难度中等,侧重于考查学生的实验能力和对基础知识的应用能力.

| A. | 一定不存在③⑥ | B. | 可能存在①② | C. | 一定存在①④⑦ | D. | 至少存在④⑤⑦ |
反应原理:
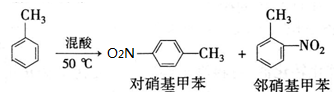
实验中可能用到的数据:
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液体烃 |
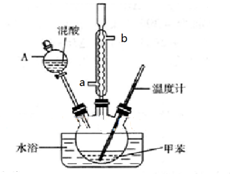
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到纯净的一硝基甲苯共15g.
请回答下列问题:
(1)实验前需要在三颈瓶中加入少许沸石(或碎瓷片),目的是防止爆沸.
(2)冷凝管的作用是冷凝回流;冷却水从冷凝管的a(填“a”或“b”)端进入.
(3)仪器A的名称是分液漏斗,使用该仪器前必须进行的操作是检查是否漏液.
(4)分离反应后产物的方案如下:

其中,操作1的名称为分液,操作2必需的玻璃仪器有酒精灯、温度计、锥形瓶、牛角管(尾接管)和蒸馏烧瓶、冷凝管.
(5)本实验中一硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )| A. | 2:3 | B. | 1:3 | C. | 3:2 | D. | 2:1 |
| A. | $\frac{4b-2a}{V}$ | B. | (2b-2a)/V | C. | (2b-a)/V | D. | (b-2a)/V |
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中方程的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中方程的热量可计算中和热,回答下列问题: