题目内容
14.抗氧剂亚硫酸钠可利用硫酸工业的炉气和尾气与纯碱反应来制取,生产流程如图1:
己知:①炉气、尾气中均含有SO2、水蒸气等;②“混合反应”中还溶解有少量Fe2O3、MgO等矿尘.
(1)“混合反应”中纯碱(Na2CO3)参与反应的化学方程式为:SO2+Na2CO3=Na2SO3+CO2↑(或2SO2+Na2CO3+H2O=2NaHSO3+CO2↑)(任写一个).
(2)用NaOH“除杂”时,主要的离子方程式为:Fe2++2OH-=Fe(OH)2↓(或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O))(任写一个).
(3)通过“操作I”可以得到亚硫酸钠晶体,其操作过程包括:加热蒸发浓缩、冷却结晶、过滤(写出主要步骤名称)及洗涤、干燥.
(4)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)=2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如图2中曲线I所示.
下列判断正确的是AC(填序号).
A.该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:υA>υC
C.反应达到B点时,2υ正(O2)=υ逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则Ⅱ是Fe2O3作催化剂的曲线.
分析 (1)由工艺流程可知混合反应中为SO2等与纯碱(Na2CO3)的反应,SO2与纯碱(Na2CO3)溶液反应生成Na2SO3(或NaHSO3)、CO2;
(2)混合反应中还溶解有少量Fe2O3、MgO等矿尘,混合反应后的溶液中含有少量的Fe2+、Mg2+、HSO3-等.Fe2+、Mg2+、HSO3-等都与OH-发生反应;
(3)从溶液中获得固体物质应采取蒸发结晶方法;
(4)由图象可知T0前反应未达平衡,T0时处于平衡状态,T0后升高温度平衡向逆反应移动.
A、T0后升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动;
B、温度升高反应速率加快;
C、不同物质表示的正逆反应速率之比等于化学计量数之比,反应到达平衡状态;
D、催化剂缩短到达平衡时间,平衡不移动.
解答 解:(1)SO2与纯碱(Na2CO3)溶液反应的方程式为SO2+Na2CO3=Na2SO3+CO2↑或2 SO2+Na2CO3+H2O=NaHSO3+CO2↑,
故答案为:SO2+Na2CO3=Na2SO3+CO2↑或2 SO2+Na2CO3+H2O=NaHSO3+CO2↑;
(2)合反应后的溶液中含有少量的Fe2+、Mg2+、HSO3-等.Fe2+、Mg2+、HSO3-等都与OH-发生反应,发生反应离子方程式为Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O,
故答案为:Fe2++2OH-=Fe(OH)2↓或Mg2++2OH-=Mg(OH)2↓或HSO3-+OH-=SO32-+H2O;
(3)从溶液中获得固体物质应加热蒸发、冷却结晶、过滤、洗涤干燥,故答案为:冷却结晶;过滤;
(4)由图象可知T0前反应未达平衡,T0时处于平衡状态,T0后升高温度平衡向逆反应移动.
A、T0后升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B、A未达平衡,B处于平衡状态,反应速率比A点高,T0后温度升高反应速率加快,平衡向逆反应移动,但比B点的速率高,所以:vA<vC,故B错误;
C、不同物质表示的正逆反应速率之比等于化学计量数之比,反应到达平衡状态,反应达到B点时,到达平衡状态,所以2v正(O2)=v逆(SO3),故C正确;
D、使用催化剂,加快反应速率,缩短到达平衡时间,但平衡不移动,用V2O5催化剂与Fe2O3作催化剂,到达平衡时三氧化硫的含量相同,故D错误;
故答案为:AC.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应及混合物分离方法为解答的关键,注意对工艺流程的理解及常用化学用语、化学平衡及图象分析等,要求学生有扎实的基础知识以及综合运用知识解决问题的能力,综合性较强,题目难度中等.

| A. | CH3-C(CH3)=CH-CH3 | B. | CH3-CCl=CH-CH3 | C. | 1-丁烯 | D. | 丙烯 |
| A. | 苯的硝化、乙烯使高锰酸钾酸性溶液褪色的反应都属于取代反应 | |
| B. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| C. | 乙烯、苯、乙烷分子中的所有原子都在同一平面上 | |
| D. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
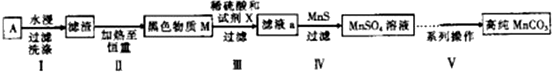
(1)碱性锌锰干电池的负极材料是Zn(填化学式).
(2)第Ⅱ步操作的目的是除去碳粉.
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为Zn2++MnS=ZnS+Mn2+.(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5g 黑色物质M进行制备MnSO3的实验,得到数据如下表:
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为MnO2+H2O2+H2SO4=MnSO4+2H2O+O2↑.
(5)已知:MaCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂:NaHCO3、乙醇)
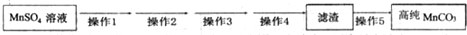
操作1:加入NaHCO3,控制pH<7.7;
操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净;
操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干.
(6)操作1可能发生反应的离子方程式Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.

 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.如图是过氧化氢法生产亚氯酸钠的工艺流程图:
 ;Na2O2的电子式:
;Na2O2的电子式: ,H2S的电子式:
,H2S的电子式:
 .
. .
.