题目内容
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
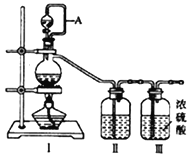
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
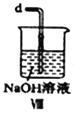
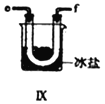
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
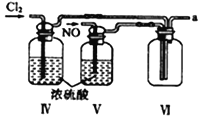
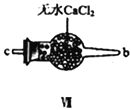
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
【答案】 浓盐酸 饱和食盐水 稀硝酸 水 通过观察气泡调节气体的流速 e→f→c→b→d(或f→e→c→b→d) 防止水蒸气进入反应器 U型管内充满黄色气体,并有红色液体凝结 NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O
【解析】(1)实验室用二氧化锰与浓盐酸加热反应制备氯气,分液漏斗中加入浓盐酸;生成的氯气中含有杂质氯化氢、水蒸气;因此混合气体进入装有饱和食盐水的装置Ⅱ中,以除去氯化氢,因此②中加入饱和食盐水;实验室用铜和稀硝酸反应制备一氧化氮,分液漏斗中加入稀硝酸;由于装置内有空气,会有一氧化氮部分氧化为二氧化氮,因此混合气体进入盛有水装置Ⅱ中,除去二氧化氮;正确答案:浓盐酸;饱和食盐水;稀硝酸; 水。
(2)装置Ⅳ、Ⅴ装有浓硫酸,除可进一步干燥NO、Cl2外,另一个作用通过观察气泡的多少来控制气体的速率;正确答案:通过观察气泡调节气体的流速。
(3)氯气和一氧化氮混合后在装置IV中发生反应生成NOCl,通过a进入到IX装置内,进行液化,收集NOCl,多余的尾气再用碱液吸收的同时,必须用VII装置吸收水蒸气,以防止NOCl与水发生水解;所以装置连顺序为a→e→f→c→b→d(或f→e→c→b→d),正确答案:e→f→c→b→d(或f→e→c→b→d)。
(4)装置Ⅴ中装有浓硫酸,起到干燥气体,防止水蒸气进入反应器,正确答案:防止水蒸气进入反应器。
(5)已知:亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解;根据信息可知:装置Ⅸ中观察到的现象U型管内充满黄色气体,并有红色液体凝结;正确答案:U型管内充满黄色气体,并有红色液体凝结。
(6)装置Ⅷ中装有碱液,吸收尾气时,氢氧化钠溶液与NOCl发生反应生成氯化钠和亚硝酸钠;化学方程式为:NOCl+2NaOH=NaCl+NaNO2+H2O ;正确答案: NOCl+2NaOH=NaCl+NaNO2+H2O。
(7)浓硝酸与浓盐酸混合时发生氧化还原反应,生成亚硝酰氯和氯气,该反应的化学方程式为HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O;正确答案:HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O。

【题目】利用铝锂钴废料(主要成分为Co3O4,还含有少量铝箔、LiCoO2等杂质)回收CoO的工艺流程如下:
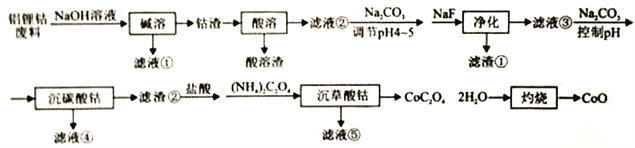
回答下列问题:
(1)“碱溶”的目的是:________________。
(2)不同浸出剂“酸溶”实验结果见下表,根据数据和物质性质应选择的浸出剂是___________(填序号),理由是__________ (用Co3O4参与反应的离子方程式表示)。
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
(a)HCI | 80.84 | 5.68 | 98.4 |
(b)H2SO4 | 65.0 | 6.22 | 72.3 |
(c)H2SO4+ Na2S2O3 | 84.91 | 5.96 | 98.0 |
(3)“净化”产生的滤渣为____________(填化学式),滤液③中c(F-)=4.0×10-3mol·L-1,则“净化”后残余c(Li+)=___________。LiF与Li2CO3的Ksp分别为1.8×10-3、1.7×10-3。
(4)若滤液④中含Co2+为5.9×10-2g·L-1,“沉碳酸钴"应控制pH不高于___________。Co(OH)2的Ksp为1.0×10-15。
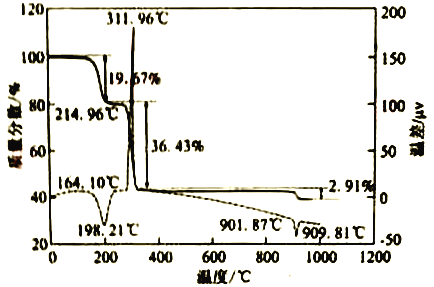
(5)“沉碳酸钴“→“沉草酸钻”的目的是___________。
(6)CaC2O4·H2O在空气氛围中的热重曲线如下图。在311.96℃附近有个很强的放热峰的原因是______。900℃发生反应的化学方程式为___________。