题目内容
【题目】通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,离子不存在。图为H3PO4(图中用H3A表示)在加入强酸或强碱溶液后,平衡时溶液中各微粒浓度的对数值(lgc)-pH图。下列说法不正确的是( )
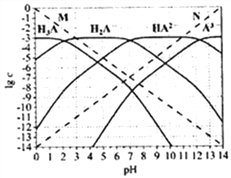
A. H3PO4、H2PO4-、HPO42-、PO43-不能在同一溶液中大量共存
B. H3PO4电离平衡常数Ka2≈1×10-7
C. 图中虚线M、N分别代表H+和OH-
D. pH=10时,溶液中存在关系:c(HPO42-)>c(OH-)>c(PO43-)>c(H2PO4-)>c(H3PO4)>c(H+)
【答案】D
【解析】H3PO4存在的溶液中酸性较强,PO43-存在的溶液中碱性较强,因此两种粒子不能在同一溶液中大量共存;A正确;从图像可知:磷酸的第二步电离平衡常数Ka2= c(H+)×c(HPO42-)/ c(H2PO4-),当c(HPO42-)= c(H2PO4-),溶液的pH=7,c(H+)=1×10-7,所以H3PO4电离平衡常数Ka2≈1×10-7,B正确;图中虚线变化可知,M曲线的代表的是H+的浓度逐渐减小的过程,溶液的酸性逐渐减弱;N曲线代表的是OH-浓度增大的过程,溶液的碱性逐渐增强,C正确;从图像可知:pH=10时,c(OH-)=10-4mol/L,而c(PO43-)=c(H2PO4-)=10-6mol/L,溶液中存在关系为:c(HPO42-)>c(OH-)>c(PO43-)=c(H2PO4-)>c(H3PO4)>c(H+),所以D错误;正确选项D。

【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
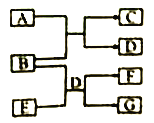
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
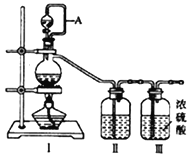
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
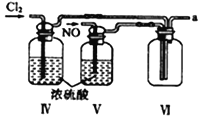
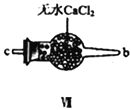
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
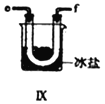
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
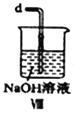
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。