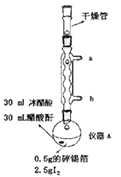
题目内容
【题目】某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A暴露在空气中足够长时间变为C,B和酸性气体D能生成C,A和B都能与水生成E,E和D也能生成C。回答下列问题。
(1)写出下列物质的化学式:C_____________,D_____________,E_____________。
(2)写出下列反应的化学方程式:
①A和水生成E:______________________________________________________;
②B和D生成C:______________________________________________________;
③A在空气中加热:___________________________________________________。
【答案】Na2CO3 CO2 NaOH 2Na+2H2O═2NaOH+H2↑ 2Na2O2+2CO2═2Na2CO3+O2 2Na+O2![]() Na2O2
Na2O2
【解析】
某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,则A是Na、B是Na2O2,A露置在空气中足够长时间变为C,银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO310H2O)→最后变成Na2CO3粉(风化),有关反应有:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO310H2O、Na2CO310H2O=Na2CO3+10H2O,则C是Na2CO3,B和酸性气体D能生成C,则D是CO2,A和B都能与水生成E,则E是NaOH;据此分析可得结论。
(1)通过以上分析知,A、B、C、D、E分别是Na、Na2O2、Na2CO3、CO2、NaOH,
故答案为:Na2CO3、CO2、NaOH;
(2)①钠和水反应生成NaOH和氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
②过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
③钠在空气中加热生成过氧化钠,反应方程式为:2Na+O2![]() Na2O2。
Na2O2。

【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
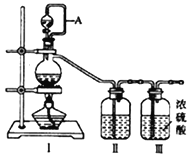
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
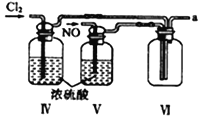
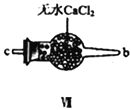
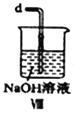
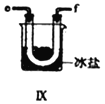
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。