题目内容
【题目】下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.将浓氨水加入到碱石灰固体中
D.将NH4Cl溶液和NaOH溶液混合
【答案】C
【解析】
A. 氮气与氢气的反应是可逆反应,反应不能进行到底,且得到的产物不纯净,反应条件要求高,适合工业制取氨气,不适合实验室制取氨气,A项错误;
B. NH4Cl受热分解生成氨气和HCl,冷却后氨气和HCl又合成NH4Cl,不能得到纯净的氨气,所以不适合实验室制取氨气,B项错误;
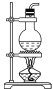
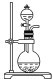
C. 碱石灰固体溶于水放热,可促进从氨水中氨气的挥发,因此可用浓氨水加入到碱石灰固体中制备氨气,C项正确;
D. 将NH4Cl溶液和NaOH溶液混合,生成NH3H2O和氯化钠,得不到氨气,D项错误;
答案选C。
方法 | 化学方程式(或原理) | 发生装置 |
加热浓氨水 | NH3·H2O |
|
固体NaOH | NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的生成 |
|
浓氨水+固体CaO | CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解。化学方程式NH3·H2O+CaO=NH3↑+Ca(OH)2 |

【题目】硒和碲的单质是重要的高新技术材料。一种以含贵重金属的“酸泥”(含Se、Te、Ag、Pb、Cu等单质)为原料制备硒和碲的工艺流程如图所示。
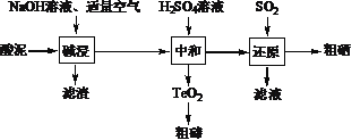
已知:①H2SeO3易溶于水,TeO2不溶于水。
②“中和”过程中测得不同pH下相关数据如下表:
“中和”终点pH | 滤液/(g·L-1) | 沉淀率/% | ||
Se | Te | Se | Te | |
4 | 11.2 | 0.029 | 8.9 | 98.1 |
5 | 13.7 | 0.01 | 5.8 | 98.9 |
6 | 12.4 | 0.013 | 4.1 | 91.6 |
回答下列问题:
(1)已知“碱浸”过程中生成了Na2SeO3和Na2TeO3,则“滤渣”中含有Cu和__。写出Se参加反应的离子方程式____。
(2)“碱浸”过程中通入空气应适量的原因是___。
(3)“中和”过程中生成TeO2的化学方程式是____。
(4)“中和”终点pH应选择在____附近,原因是___。
(5)“滤液”可返回____工序循环使用。
(6)要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2____L。