题目内容
【题目】对下列探究反应速率和化学平衡影响因素的四个实验,回答下列问题:
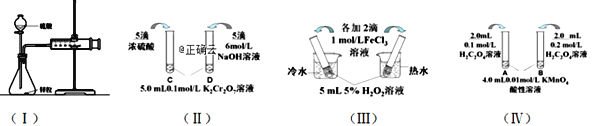
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,可以测定收集一定体积氢气所用的时间。此方法需要控制的变量有(至少写出两项):______________________。
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
2CrO42- (黄色)+ 2H+。D试管中实验现象为______________,用平衡移动原理解释原因:_______________
(3)实验(Ⅲ)中实验目的是探究____________________。
(4)在室温下进行实验(Ⅳ)溶液褪色的时间:t(A)________t(B)(填>、<或= )
【答案】温度,锌粒大小 溶液由橙色变为黄色 加NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大 探究温度对反应速率的影响 >
【解析】
(1)探究锌与不同浓度的硫酸反应的速率时,需要在同一温度下,使用同样的锌粒,测定收集一定体积氢气所用的时间;
(2)针对Cr2O72- (橙色)+ H2O![]() 2CrO42- (黄色)+ 2H+反应,加入氢氧化钠溶液,c(H+)减小,平衡右移,c(CrO42-)增大,据此进行分析;
2CrO42- (黄色)+ 2H+反应,加入氢氧化钠溶液,c(H+)减小,平衡右移,c(CrO42-)增大,据此进行分析;
(3)反应物的浓度、催化剂的浓度相同,探究外界温度对双氧水的分解速率的影响;
(4)同一条件下,相同浓度的高锰酸钾溶液,不同浓度的草酸溶液,二者发生反应,草酸溶液浓度越大的反应速率快,所需时间短。
(1)利用实验(Ⅰ)探究锌与1mol/L硫酸和4mol/L硫酸反应的速率,在同一温度下,测定收集一定体积氢气所用的时间, 同时要注意使用的锌粒的大小要相同,因为固体的表面积不同也会影响反应速率的快慢;
故答案是:温度,锌粒大小;
(2)实验(Ⅱ)已知:Cr2O72- (橙色)+ H2O![]() 2CrO42- (黄色)+ 2H+。D试管中,加入氢氧化钠溶液,中和了氢离子,c(H+)减小,平衡右移,c(CrO42-)增大,溶液有橙色变为黄色;
2CrO42- (黄色)+ 2H+。D试管中,加入氢氧化钠溶液,中和了氢离子,c(H+)减小,平衡右移,c(CrO42-)增大,溶液有橙色变为黄色;
故答案是:溶液由橙黄色变为黄色;加NaOH溶液使c(H+)减小,平衡右移,c(CrO42-)增大;
(3)同种反应物的浓度相同,同种催化剂的浓度相同,但是反应的外界温度不同,双氧水的分解速率不同;实验(Ⅲ)中实验目的是探究温度对反应速率的影响;
故答案是:探究温度对反应速率的影响;
(4)相同浓度的高锰酸钾溶液,不同浓度的草酸溶液,可以测定二者在室温下进行实验(Ⅳ)溶液褪色的时间,浓度大的反应速率快,时间短,所以t(A) >t(B);
故答案是:>。