题目内容
【题目】某草酸亚铁水合物A可用于制作照相显影剂、制药等。下面是对该化合物的制备及分析的实验方案。

请回答下列问题。
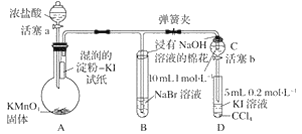
(1)硫酸亚铁的制备及收集纯净的氢气:将2.00g铁粉(含少量FeS及其他难溶性杂质)放入150mL锥形瓶中,加入25mL 3 mol/L H2SO4,水浴加热。反应完毕趁热过滤,反应装置如下图所示(每个装置限用一次)。
①使用以上装置完成实验,指出装置连接顺序:a______________。
②反应完毕后趁热过滤的目的是________________________。
(2)草酸亚铁水合物A的制备:将滤液转移至事先已盛有50 mL 1 mol/L H2C2O4溶液的250mL烧杯中,搅拌下加热至沸腾,一段时间后得到淡黄色沉淀(其主要成分为A)。
①已知A中铁的质量分数为31%,其化学式为____________。
②3.6g A 在无氧条件下加热,最终得到1.44g 固体化合物,试写出该过程中发生反应的化学方程式:___________________________。
③若对实验方案中的硫酸加入量略作调整,可以得到更高产率的A,试用化学平衡的相关知识分析,并指出该调整是增加还是减少硫酸的量:________。
(3)草酸亚铁水合物A纯度的测定:称取mg产物于100mL烧杯中,用2 mol/L H2SO4溶解,转移至250 mL容量瓶中并用2 mol/L H2SO4定容。移取25.00mL溶液至 250 mL 锥形瓶中,微热后用浓度为c mol/L的标准高锰酸钾溶液滴定,平行测定三次,平均消耗滴定剂VmL(假设杂质不参与滴定反应)。
①写出滴定过程中发生反应的离子方程式:___________________________ ;
②列出表示产物中A的纯度的计算式:_______________________。
【答案】edcbgfh 防止硫酸亚铁晶体析出 FeC2O42H2O FeC2O42H2O![]() FeO+CO↑+CO2↑+2H2O 减少,经粗略计算得知第一步用于溶解Fe的硫酸是远远过量的,草酸是弱酸,H+浓度增大,C2O42-浓度减少,不利于草酸亚铁沉淀生成,故减少硫酸的量 5FeC2O4+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O [(5cV10-3×250.0×180)/(3×25.00×m)]×100%
FeO+CO↑+CO2↑+2H2O 减少,经粗略计算得知第一步用于溶解Fe的硫酸是远远过量的,草酸是弱酸,H+浓度增大,C2O42-浓度减少,不利于草酸亚铁沉淀生成,故减少硫酸的量 5FeC2O4+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O [(5cV10-3×250.0×180)/(3×25.00×m)]×100%
【解析】
(1)①产生的H2中含有H2S和水蒸气,从a中出来的气体依次通过NaOH溶液除去H2S,CuSO4溶液检验H2S是否除尽,浓硫酸除去水蒸气,最后用真空球囊收集纯净的H2,故装置连接顺序:aedcbgfh;
②反应完毕后,除去未反应的固体,同时又防止硫酸亚铁晶体析出,故采用趁热过滤的方式;
(2)①令草酸亚铁水合物A的化学式为FeC2O4xH2O,![]() ,解得x=2,A的化学式为FeC2O42H2O;
,解得x=2,A的化学式为FeC2O42H2O;
②![]() ,n(Fe)=0.02mol,m(Fe)=0.02mol×56g/mol=1.12g,最终得到1.44g 固体化合物,
,n(Fe)=0.02mol,m(Fe)=0.02mol×56g/mol=1.12g,最终得到1.44g 固体化合物,![]() ,因此所得固体是FeO,根据氧化还原反应中得失电子守恒,该过程中发生反应的化学方程式:FeC2O42H2O
,因此所得固体是FeO,根据氧化还原反应中得失电子守恒,该过程中发生反应的化学方程式:FeC2O42H2O![]() FeO+CO↑+CO2↑+2H2O;
FeO+CO↑+CO2↑+2H2O;
③25mL 3 mol/L H2SO4的物质的量为0.075mol,2.00g铁粉的物质的量为0.036mol,Fe+H2SO4=FeSO4+H2↑,所以第一步用于溶解Fe的硫酸是过量的,草酸是弱酸,H+浓度增大,C2O42-浓度减少,不利于草酸亚铁沉淀生成,故应减少硫酸的量;
(3)①草酸亚铁难溶,在书写离子方程式时应写成分子式,故滴定过程中发生反应的离子方程式为5FeC2O4+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O;
②5FeC2O4+3MnO4-+24H+=5Fe3++10CO2↑+3Mn2++12H2O,反应物、生成物变化的物质的量之比等于化学计量数之比,即n(FeC2O4):n(KMnO4)=5:3,n(FeC2O4)=![]() ,从250 mL容量瓶中移取25.00mL溶液,所以产物中FeC2O42H2O的纯度为
,从250 mL容量瓶中移取25.00mL溶液,所以产物中FeC2O42H2O的纯度为![]() 。
。