题目内容
【题目】某温度下,将6 mol CO2和8 mol H2充入2 L密闭容器中发生反应CO2(g) +3H2(g)CH3OH(g) + H2O(g) ΔH < 0,容器中H2的物质的量随时间的变化关系如图中的实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系。下列说法正确的是
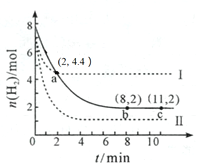
A.曲线Ⅰ对应的条件改变可能降低温度
B.曲线Ⅱ对应的条件改变可能是充入氦气
C.该温度下,此反应的化学平衡常数的数值为0.5
D.从反应开始至a 点,ν(CO2) = 0.6 mol·L-1·min-1
【答案】C
【解析】
A.曲线Ⅰ和原平衡相比,氢气的转化率降低,但到达平衡的时间减少,说明反应速率加快。若降低温度,速率减慢,平衡向正反应方向移动,氢气的转化率增大,错误;
B.充入氦气,平衡不移动,而曲线Ⅱ到达平衡的时间减少,说明反应速率加快,不可能是充入氦气,错误;
C.平衡时氢气是2mol,则消耗氢气是6mol,所以同时消耗CO2是2mol,平衡时CO2是4mol,生成2mol甲醇和2mol水,所以平衡常数=![]() ,正确;
,正确;
D.根据图象,在a点时,消耗氢气3.6mol,同时消耗CO2是1.2mol,所以ν(CO2)= =0.3 mol·L-1·min-1,错误。
=0.3 mol·L-1·min-1,错误。

 名校课堂系列答案
名校课堂系列答案【题目】汽车发动机中生成NO的反应为:![]() ,
,![]() 时该反应的化学平衡常数
时该反应的化学平衡常数![]() 。在
。在![]() 下甲、乙、丙三个恒容密闭容器中,投入
下甲、乙、丙三个恒容密闭容器中,投入![]() 和
和![]() 模拟反应,起始浓度如下表所示。下列判断不正确的是.
模拟反应,起始浓度如下表所示。下列判断不正确的是.
起始浓度 | 甲 | 乙 | 丙 |
|
|
|
|
|
|
|
|
A.起始时,反应速率:丙![]() 甲
甲![]() 乙
乙
B.平衡时,![]() :甲
:甲![]() 丙
丙![]() 乙
乙
C.平衡时,![]() 的转化率:甲
的转化率:甲![]() 乙
乙
D.平衡时,甲中![]()
【题目】某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)=2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa) | 温度/℃ | NO达到所列转化率需要时间/s | ||
50% | 90% | 98% | ||
1.0 | 30 | 12 | 250 | 2830 |
90 | 25 | 510 | 5760 | |
8.0 | 30 | 0.2 | 3.9 | 36 |
90 | 0.6 | 7.9 | 74 | |
根据表中数据,下列说法正确的是
A. 升高温度,反应速率加快
B. 增大压强,反应速率变慢
C. 在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡
D. 若进入反应塔的混合气体为amol,反应速率以v=△n/△t表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s