题目内容
【题目】I.如图转化关系所示(部分反应物略去):组成单质丁的元素存在三种核素,其中一种核素没有中子。三种核素中质量数最大的原子可表示为__________
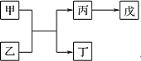
(1)由组成单质丁的元素与另一种元素形成的三核 10电子微粒所构成的物质的用途__________________________
(2)乙为 NaOH,若戊为不溶于强酸,但溶于强碱的沉淀物,则甲乙反应时作氧化剂的是__________________
(3)丙→戊反应的化学方程式为_______________________
(4)若戊为既能溶于强酸又能溶于强碱的沉淀物,则甲和乙反应的离子方程式为____________________
II.A、B、C、D 是原子序数依次增大的五种短周期主族元素,其中 A 的原子序数是 B 和 D 原子序数之和的 1/4,C 元素的单质能在A 元素最高价氧化物中燃烧,甲和丙是 D 元素的两种常见氧化物,乙和丁是 B 元素的两种常见同素异形体,1 L 0.005mol·L-1 戊溶液中含 H+ 0.01mol。它们之间的转化关系仍如上图所示(部分反应物省略),
(5)B、C 的元素符号分别是____________________、___________________________其甲和乙反应生成丙和丁的化学方程式为_________________________。
【答案】T 做溶剂 H2O 或水 Na2SiO3 +2HCl = 2NaCl + H2SiO3↓ 2Al+2OH-+6H2O ==2[Al(OH)4]-+3H2↑ O Mg (7). SO2+O3=SO3+ O2
【解析】
I.组成单质丁的元素存在三种核素,其中一种核素没有中子,丁是H2;H元素与另一种元素形成的三核 10电子微粒是H2O;若戊为不溶于强酸,但溶于强碱的沉淀物,则戊为H2SiO3、甲为Si、丙为Na2SiO3;若戊为既能溶于强酸又能溶于强碱的沉淀物,则戊为Al(OH)3、甲为Al、丙为Na[Al(OH)4];
II.1 L 0.005mol·L-1 戊溶液中含 H+ 0.01mol,则戊为H2SO4;甲和丙是D元素的两种常见氧化物,可知丙为SO3,甲为SO2,乙和丁是B元素的两种常见同素异形体,乙为O3,丁为O2,则B为O元素,D为S元素, A的原子序数是B和D原子序数之和的![]() ,A的原子序数为(8+16)×
,A的原子序数为(8+16)×![]() =6,可知A为C元素;C 元素的单质在CO2中燃烧,C是Mg元素。
=6,可知A为C元素;C 元素的单质在CO2中燃烧,C是Mg元素。
I.组成单质丁的元素存在三种核素,其中一种核素没有中子,丁是H2,氢元素的三种核素中质量数最大是3,该原子可表示为T;
(1)H元素与另一种元素形成的三核 10电子微粒是H2O,水常做溶剂;
(2)若戊为不溶于强酸,但溶于强碱的沉淀物,则戊为H2SiO3、甲为Si、丙为Na2SiO3;则甲乙反应的方程式是Si+2NaOH+H 2 O=Na 2SiO 3+2H 2↑,水中氢元素化合价降低,作氧化剂的是水;
(3)Na2SiO3和盐酸反应生成硅酸沉淀和氯化钠,反应的化学方程式为Na2SiO3 +2HCl = 2NaCl + H2SiO3↓;
(4)若戊为既能溶于强酸又能溶于强碱的沉淀物,则戊为Al(OH)3、甲为Al、丙为Na[Al(OH)4];则铝和氢氧化钠反应生成四羟基合铝酸钠与氢气,反应的离子方程式为2Al+2OH-+6H2O === 2[Al(OH)4]-+3H2↑;
(5)根据以上分析,B、C 的元素符号分别是O、Mg;甲为SO2、乙为O3,SO2和O3反应生成SO3和O2,反应的化学方程式为SO2+O3=SO3+ O2;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知反应![]()
![]() ,起始加入量
,起始加入量![]() 为
为![]() ,
,![]() 为
为![]() ,HCOOH为
,HCOOH为![]() ,在一定温度下,不同时刻甲酸乙酯的物质的量如下:
,在一定温度下,不同时刻甲酸乙酯的物质的量如下:![]() 注:本题速率单位用
注:本题速率单位用![]() 表示
表示![]()
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
|
|
|
|
|
|
|
|
|
|
|
|
|
下列说法不正确的是 ![]()
![]()
A.以表中![]() 为单位,
为单位,![]() 内最大的平均反应速率在
内最大的平均反应速率在![]() 之间
之间
B.前![]() 甲酸乙酯的平均反应速率为
甲酸乙酯的平均反应速率为![]()
C.甲酸乙酯的反应速率先增大后减小的原因是该反应放热
D.开始时若加适量的NaOH,也可以加快甲酸乙酯水解速率