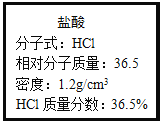
��Ŀ����
����Ŀ��ʯ���ѽ�����;�㷺�������ںϳɸ�����ҽҩ�м��塣����ʯ���ѽ����ϳ�CR��ҽҩ�м���K��·����ͼ��

��֪��I.�ȴ���D����Է���������113���ȵ���������ԼΪ62.8%���˴Ź����������֮��Ϊ2�U1��
��.
(1)A��˳ʽ�칹��Ľṹ��ʽΪ___________��D��ϵͳ������___________��
(2)��Ӧ�ڵ�������___________������д���ٺ͢۵ķ�Ӧ���ͣ�___________��___________��
(3)д��F��G�����е�һ����Ӧ�Ļ�ѧ����ʽ��_________________________________��
(4)G�����������������Ӧ��д��G���Ҷ��������ۺϷ�Ӧ�Ļ�ѧ����ʽ��________��
(5)д����G��2��̼ԭ�ӵ�ͬϵ�������ͬ���칹��Ľṹ��ʽ��___________��
(6)��֪˫���ϵ���ԭ�Ӻ��ѷ���ȡ����Ӧ����AΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�B__���ϳ�·������ͼʾ�磺
���𰸡�![]() 1��3-���ȱ��� NaOH��Һ���������ȣ� �Ӿ۷�Ӧ ȡ����Ӧ OHCCH2CHO+4Ag(NH3)2OH
1��3-���ȱ��� NaOH��Һ���������ȣ� �Ӿ۷�Ӧ ȡ����Ӧ OHCCH2CHO+4Ag(NH3)2OH![]() NH4OOCCH2COONH4+2H2O+4Ag��+6NH3
NH4OOCCH2COONH4+2H2O+4Ag��+6NH3 ![]()
![]()
![]() ��
��![]() ��
��![]() ��
��![]()
![]()
��������
��������ͼ��1,3-����ϩ���巢��1,4�ӳɣ�����A��AΪ1,4-����-2-��ϩ(![]() )���������ӳɺ�����1,4-���嶡��(
)���������ӳɺ�����1,4-���嶡��(![]() )�����ȴ���D����Է���������113���ȵ���������ԼΪ62.8%���˴Ź����������֮��Ϊ2�U1��֪D�ķ���ʽΪC3H6Cl2���������̽ṹ��ʽ��֪D�Ľṹ��ʽΪ
)�����ȴ���D����Է���������113���ȵ���������ԼΪ62.8%���˴Ź����������֮��Ϊ2�U1��֪D�ķ���ʽΪC3H6Cl2���������̽ṹ��ʽ��֪D�Ľṹ��ʽΪ![]() ��
��![]() ������������Һ�м��ȷ���ˮ�ⷴӦ����
������������Һ�м��ȷ���ˮ�ⷴӦ����![]() ����EΪ
����EΪ![]() ��
��![]() ��ͭ�����������£����������ȷ�����������Ӧ����OHCCH2CHO����FΪOHCCH2CHO��OHCCH2CHO����������Ӧ���ữ�õ�HOOCCH2COOH����GΪHOOCCH2COOH��HOOCCH2COOH���Ҵ���Ũ���������¼��ȷ���������Ӧ����CH3CH2OOCCH2COOCH2CH3����HΪCH3CH2OOCCH2COOCH2CH3��CH3CH2OOCCH2COOCH2CH3��
��ͭ�����������£����������ȷ�����������Ӧ����OHCCH2CHO����FΪOHCCH2CHO��OHCCH2CHO����������Ӧ���ữ�õ�HOOCCH2COOH����GΪHOOCCH2COOH��HOOCCH2COOH���Ҵ���Ũ���������¼��ȷ���������Ӧ����CH3CH2OOCCH2COOCH2CH3����HΪCH3CH2OOCCH2COOCH2CH3��CH3CH2OOCCH2COOCH2CH3��![]() ������Ϣ��Ӧ����
������Ϣ��Ӧ����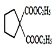 ��
�� 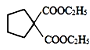 ��һ����Ӧ����K(
��һ����Ӧ����K(![]() )��
)��
��1��AΪ1,4-����-2-��ϩ(![]() )������˳ʽ�ͷ�ʽ�칹�壬˳ʽ�칹��Ľṹ��ʽΪ
)������˳ʽ�ͷ�ʽ�칹�壬˳ʽ�칹��Ľṹ��ʽΪ![]() ��D�Ľṹ��ʽΪ
��D�Ľṹ��ʽΪ![]() ��������Ϊ1��3-���ȱ��飬�ʴ�Ϊ��
��������Ϊ1��3-���ȱ��飬�ʴ�Ϊ��![]() ��1��3-���ȱ��飻
��1��3-���ȱ��飻
��2����Ӧ��Ϊ![]() ������������Һ�м��ȷ���ˮ�ⷴӦ����
������������Һ�м��ȷ���ˮ�ⷴӦ����![]() ����Ӧ��Ϊ2���ȡ�1,3����ϩ�����Ӿ۷�Ӧ����CR����Ӧ��ΪCH3CH2OOCCH2COOCH2CH3��
����Ӧ��Ϊ2���ȡ�1,3����ϩ�����Ӿ۷�Ӧ����CR����Ӧ��ΪCH3CH2OOCCH2COOCH2CH3��![]() �ڼ״��������·���ȡ����Ӧ����
�ڼ״��������·���ȡ����Ӧ���� ���ʴ�Ϊ��NaOH��Һ���������ȣ����Ӿ۷�Ӧ��ȡ����Ӧ��
���ʴ�Ϊ��NaOH��Һ���������ȣ����Ӿ۷�Ӧ��ȡ����Ӧ��
��3��F��G�����е�һ����ӦΪOHCCH2CHO����������Ӧ����Ӧ�Ļ�ѧ����ʽΪOHCCH2CHO+4Ag(NH3)2OH![]() NH4OOCCH2COONH4+2H2O+4Ag��+6NH3���ʴ�Ϊ��OHCCH2CHO+
NH4OOCCH2COONH4+2H2O+4Ag��+6NH3���ʴ�Ϊ��OHCCH2CHO+
4Ag(NH3)2OHNH4OOCCH2COONH4+2H2O+4Ag��+6NH3��
��4��GΪHOOCCH2COOH��һ��������HOOCCH2COOH���Ҷ�����������ˮ�ⷴӦ����HO![]() COCH2COOCH2CH2O
COCH2COOCH2CH2O![]() H��ˮ����Ӧ�Ļ�ѧ����ʽΪnHOOCCH2COOH��nHOCH2CH2OH
H��ˮ����Ӧ�Ļ�ѧ����ʽΪnHOOCCH2COOH��nHOCH2CH2OH![]() HO
HO![]() COCH2COOCH2CH2O
COCH2COOCH2CH2O![]() H��(2n��1) H2O���ʴ�Ϊ��nHOOCCH2COOH��nHOCH2CH2OH
H��(2n��1) H2O���ʴ�Ϊ��nHOOCCH2COOH��nHOCH2CH2OH![]() HO
HO![]() COCH2COOCH2CH2O
COCH2COOCH2CH2O![]() H��(2n��1) H2O��
H��(2n��1) H2O��
��5��GΪHOOCCH2COOH����G��2��̼ԭ�ӵ�ͬϵ���ͬ���칹��Ϊ![]() ��
��![]() ��
��![]() ��
��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��
��6��AΪ![]() ��BΪ
��BΪ![]() ����AΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�B��������֪˫���ϵ���ԭ�Ӻ��ѷ���ȡ����Ӧ�����Ƚ��л���A�е���ԭ��ˮ��Ϊ�ǻ��������Ȼ���ӳ�����
����AΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�B��������֪˫���ϵ���ԭ�Ӻ��ѷ���ȡ����Ӧ�����Ƚ��л���A�е���ԭ��ˮ��Ϊ�ǻ��������Ȼ���ӳ�����![]() ��Ȼ���ǻ���ȥ���ɣ��ʺϳ�·��Ϊ��
��Ȼ���ǻ���ȥ���ɣ��ʺϳ�·��Ϊ��
![]() ���ʴ�Ϊ��
���ʴ�Ϊ��
![]() ��
��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ���ҵ�����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2 (g)![]() CH3OH(g) ��H1��
CH3OH(g) ��H1��
��CO2 (g)+3H2 (g)![]() CH3OH(g)+H2O(g) ��H=��58kJ/mol��
CH3OH(g)+H2O(g) ��H=��58kJ/mol��
��CO2 (g)+H2(g)![]() CO(g)+H2O(g) ��H==+41k J/ mol��
CO(g)+H2O(g) ��H==+41k J/ mol��
�ش��������⣺
(1)��֪��Ӧ������صĻ�ѧ�������������±���
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/(kJ��mol��1) | 436 | 343 | 1076 | 465 | x |
��x=___________��
(2)�ϳ������n(H2)/n(CO+ CO2)=2.60ʱ����ϵ�е�COƽ��ת����(��)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ����ʾ����(CO)ֵ���¶����߶�___________(�����С��)����ԭ����_____��ͼ�е�ѹǿ�ɴ�СΪ___________�����ж�������_____________��

(3)����1mol CO2��2molH2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�ڡ����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��

������I�����Ӧ��ƽ�ⳣ����С��ϵΪK1___________K��(�������=������)��
��һ���¶��£��������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����___________(�����)��
a.������ѹǿ���� b.�״���ˮ����������ȱ��ֲ���
c.v��(H2)=3v��(CH3OH) d.2��C=0���ѵ�ͬʱ��6��H��H����
����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ____�����¶��µ�ƽ�ⳣ��Ϊ___________���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���___________��(�����)��
a.��С��Ӧ�������ݻ� b.ʹ�ú��ʵĴ���
c.����He d.��ԭ�����ٳ���CO2��H2