题目内容
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
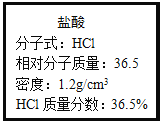
(1)该浓盐酸的物质的量浓度为___。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L稀盐酸。
①该学生需要量取____mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)___;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”)。
I、用量筒量取浓盐酸时俯视观察凹液面____
II、溶液注入容量瓶前没有恢复到室温就进行定容___
(4)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为___mol·L-1(填字母)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】12 BD 12.5 BCAFED 偏低 偏高 A
【解析】
(1)依据![]() 分析计算;
分析计算;
(2)根据n= ![]() ,结合物质的量浓度和物质的量的含义作答;
,结合物质的量浓度和物质的量的含义作答;
(3)①结合容量瓶的固定规格,根据稀释定律求出;
②依据配制一定物质的量浓度溶液的一般步骤解答;
③分析操作对溶质物质的量、溶液体积的影响,根据c=![]() 判断对所配溶液浓度的影响;
判断对所配溶液浓度的影响;
(4)根据n=![]() 计算标准状况下氯化氢气体的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据V=
计算标准状况下氯化氢气体的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据V=![]() 计算溶液的体积,根据c=
计算溶液的体积,根据c=![]() 计算该盐酸的物质的量浓度。
计算该盐酸的物质的量浓度。
(1)该浓盐酸中![]() 的物质的量浓度
的物质的量浓度![]()
![]() =12
=12![]() ;
;
(2)A. 由n= ![]() 可知溶液中
可知溶液中![]() 的物质的量随取用溶液体积的变化而变化,A项错误;
的物质的量随取用溶液体积的变化而变化,A项错误;
B. 溶液是均匀的,处处浓度相等,溶液的浓度不会随取用溶液体积的变化而变化,B项正确;
C. 溶液中![]() 的数目随所取溶液体积的变化而变化,C项错误;
的数目随所取溶液体积的变化而变化,C项错误;
D. 溶液是均匀的,溶液的密度不会随取用溶液体积的变化而变化,D项正确;
故选BD;
(3)①某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L稀盐酸,因容量瓶的规格没有450mL,需配制500mL、0.3mol/L的稀盐酸,则根据稀释定律可知稀释前后溶液所含溶质的物质的量不变,则该学生需要量取![]() =12.5 mL,故答案为:12.5;
=12.5 mL,故答案为:12.5;
②配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,
故答案为:BCAFED;
③I、用量筒量取浓盐酸时俯视观察凹液面用量筒量取浓盐酸时俯视观察凹液面,量取浓盐酸的体积偏小,溶质的物质的量偏小,溶液的浓度偏低;
II、溶液注入容量瓶前没有恢复到室温就进行定容,则配制时容量瓶中溶液的体积会偏低,导致溶液的浓度为偏高,
故答案为:偏低;偏高;
(4)HCl的物质的量为![]()
![]() ,则HCl的质量为
,则HCl的质量为![]() =
=![]() ,因1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为
,因1L水的质量为1000mL×1g/mL=1000g,故溶液的质量为![]() ,溶液的体积为
,溶液的体积为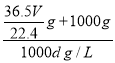 =
=![]() L,故所得溶液的物质的量浓度为
L,故所得溶液的物质的量浓度为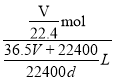 =
=![]() mol/L,A项正确,
mol/L,A项正确,
故答案为A。

【题目】无机化合物可根据其组成和性质进行分类,如下所示:
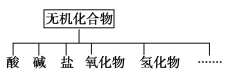
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1
①该反应在常温下_______自发进行(填“能”与“不能”);
②一定温度和压强下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是__________(填字母,下同)
a.容器中的压强不变
b.1mol H﹣H键断裂的同时断裂2mol H﹣O
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
① | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
② | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
③ | 900 | a | b | c | d | t |
①该反应为_________(填“吸”或“放”)热反应;实验②条件下平衡常数K=___________。
②实验①中从反应开始至平衡以CO2表示的平均反应速率为V(CO2)=____________(取小数点后两位)
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)CH3H(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJmol﹣1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2, 下列措施中能使c (CH3OH)增大的是_____________.

A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2和3mol H2.