题目内容
【题目】(1)甲醚(CH3OCH3)是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,写出甲醚燃烧的热化学方程式_____;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=______;
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________ kJ。
(3)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,则表示C6H6燃烧热的热化学方程式为_______________________________________。
【答案】CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol ﹣378.8kJ/mol 1.6NA 173.4 C6H6(l)+15/2O2(g)===6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1
【解析】
本题考查热化学反应方程式的书写。根据燃烧热的概念1mol可燃物完全燃烧生成稳定氧化物所放出的热量。注意标出物质的状态。
(1)甲醚的燃烧热为1455kJ/mol ,则燃烧方式的热化学方程式为: CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O △H1=﹣1455kJ/mol 。已知H2(g)和C(s)的燃烧热分别是285.8kJmol-1、393.5kJmol-1;①H2(g)+1/2O2(g)=H2O △H=-285.8kJmol-1②C(s)+O2(g)=CO2(g) △H=-393.5kJmol﹣1
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H1=﹣1455kJ/mol;根据盖斯定律计算①![]() 6+②
6+②![]() 2-③
2-③![]() ,计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=(-285.8
,计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H=(-285.8![]() 6-393.5
6-393.5![]() 4)-(-1455
4)-(-1455![]() 2)=﹣378.8kJ/mol;因此,本题正确答案是: CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8kJ/mol ;
2)=﹣378.8kJ/mol;因此,本题正确答案是: CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=﹣1455kJ/mol;﹣378.8kJ/mol ;
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
(2)由(①+ ②)/2得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),ΔH =-(574+1160)/2=kJ![]() mol-1=-867 kJ
mol-1=-867 kJ![]() mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol
mol-1,n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol![]() 8NA=1.6 NA放出的热量为0.2
8NA=1.6 NA放出的热量为0.2![]() =173.4kJ因此,本题正确答案是: 1.6NA、 173.4。
=173.4kJ因此,本题正确答案是: 1.6NA、 173.4。
(3) 燃烧热是指1mol可燃物完全燃烧,生成稳定的氧化物时所放出的热量。1C6H6完全燃烧放热41.8kJ,则1mol C6H6完全燃烧放热41.8 ![]() 78g/mol=3260.4 kJ ,故表示C6H6燃烧热的热化学方程式为C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l)ΔH=-3 260.4 kJ·mol-1。答案:C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1
78g/mol=3260.4 kJ ,故表示C6H6燃烧热的热化学方程式为C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l)ΔH=-3 260.4 kJ·mol-1。答案:C6H6(l)+15/2O2(g)=6CO2(g)+3H2O(l) ΔH=-3 260.4 kJ·mol-1

【题目】无机化合物可根据其组成和性质进行分类,如下所示:
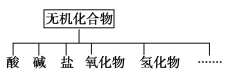
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。