题目内容
【题目】(1)2 mol O3和3 mol O2的质量之比为________,分子数之比为________,同温同压下的密度之比为________,含氧原子数之比为________,体积之比为________。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量之比是______,混合气体的平均相对分子质量是_______,对氢气的相对密度是________。
【答案】1∶1 2∶3 3∶2 1∶1 2∶3 1∶3 40 20
【解析】
(1)臭氧的摩尔质量为48g/mol,氧气的摩尔质量为32g/mol,根据m=nM知,其质量之比=(48g/mol×2):(32g/mol×3)=1:1,根据N=nNA知,其分子数之比等于其物质的量之比=2mol:3mol=2:3,相同条件下,气体摩尔体积相等,根据ρ=![]() 知,其密度之比等于其摩尔质量之比=48g/mol:32g/mol=3:2;一个臭氧分子中含有3个氧原子,一个氧气分子中含有2个氧原子,其分子数之比为2:3,结合每个分子中含有的氧原子个数知,其原子个数之比为1:1;在相同条件下,物质的量之比等于体积之比,体积之比为2:3
知,其密度之比等于其摩尔质量之比=48g/mol:32g/mol=3:2;一个臭氧分子中含有3个氧原子,一个氧气分子中含有2个氧原子,其分子数之比为2:3,结合每个分子中含有的氧原子个数知,其原子个数之比为1:1;在相同条件下,物质的量之比等于体积之比,体积之比为2:3
故答案为:1:1;2:3;3:2;1:1;2:3;
(2):设CO为xmol,CO2为ymol,则x+y=![]() ,28x+44y=12;
,28x+44y=12;
解得:x=0.075,y=0.225,
此混合物中CO和CO2的物质的量比是0.075:0.225=1:3,![]() =
=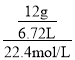 =40g/mol,摩尔质量与其相对分子质量在数值上相等,所以其相对分子质量为40,相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体的密度相对氢气的密度是20,
=40g/mol,摩尔质量与其相对分子质量在数值上相等,所以其相对分子质量为40,相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体的密度相对氢气的密度是20,
故答案为:1:3;40;20;

【题目】无机化合物可根据其组成和性质进行分类,如下所示:
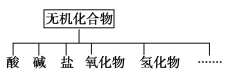
(1)上面所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②______ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出实验室由⑩制备O2的化学方程式___________________________________。