题目内容
16.对硫代硫酸钠中硫元素价态有三种意见:(1)由于硫与亚硫酸钠加热可生成硫代硫酸钠,所以Na2S2O3中硫元素价态分别为0价,+4价;(2)硫平均价态为+2价;(3)硫代硫酸钠是硫酸钠中的一个氧原子换成硫原子,硫的价态分别为-2、+6价.下列对硫代硫酸钠和反应Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O的分析正确的是( )| A. | 三种意见都支持上述反应为氧化还原反应,且电子转移数相同 | |
| B. | 通过闻生成气体气味可判断反应快慢 | |
| C. | 用稀硫酸可鉴别硫代硫酸钠、亚硫酸钠溶液 | |
| D. | 生成的气体可漂白酸性高锰酸钾溶液 |
分析 A、(1)由于硫与亚硫酸钠加热可生成硫代硫酸钠,所以Na2S2O3中硫元素价态分别为0价,+4价,没有化合价发生变化;
B、根据Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O反应,可通过出现浑浊的时间长短判断反应快慢;
C、根据稀硫酸与硫代硫酸钠反应为Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,与亚硫酸钠溶液Na2SO3+H2SO4=SO2↑+Na2SO4+H2O的现象分析判断;
D、二氧化硫具有强还原性与酸性高锰酸钾溶液具有强氧化性,两者发生氧化还原反应.
解答 解:A、(1)由于硫与亚硫酸钠加热可生成硫代硫酸钠,所以Na2S2O3中硫元素价态分别为0价,+4价,没有化合价发生变化,(2)(3)都有化合价变化支持上述反应为氧化还原反应,且电子转移数相同,故A错误;
B、根据Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O反应,可通过出现浑浊的时间长短判断反应快慢,不能通过闻生成气体气味判断,故B错误;
C、因为稀硫酸与硫代硫酸钠反应为Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O会出现浑浊,而与亚硫酸钠溶液Na2SO3+H2SO4=SO2↑+Na2SO4+H2O无浑浊,据此可以鉴别,故C正确;
D、二氧化硫具有强还原性与酸性高锰酸钾溶液具有强氧化性,两者发生氧化还原反应而使酸性高锰酸钾溶液退色,不是漂白性,故D错误;
故选:C.
点评 本题考查了硫代硫酸钠的性质,难度不大,抓住反应前后化合价的变化及其产生的现象即可解题,注意氧化还原反应原理的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
5.下列离子方程式书写正确的是( )
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | Na2S溶液中滴加NClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
6.已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为c b d a(填序号).
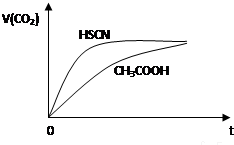
②25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②25℃时,将20mL 0.1mol•L-1CH3COOH溶液和20mL 0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是a(填序号).
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数.

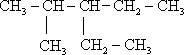 ;
;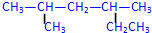 2,4-二甲基己烷
2,4-二甲基己烷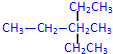 3-甲基-3-乙基戊烷
3-甲基-3-乙基戊烷 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$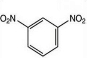 +2H2O.
+2H2O.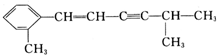 该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
 .
. ,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为
,化合物Ⅳ通过消去反应生成化合物Ⅰ的化学方程式为 .
.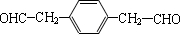 (写一种即可).
(写一种即可). 单体的结构简式为
单体的结构简式为 ;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式
;利用题中所给信息,自选合适的原料通过一步反应合成该单体,写出其化学方程式 .
.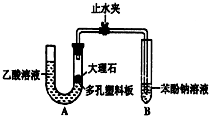 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙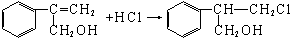 (不需注明反应条件).
(不需注明反应条件).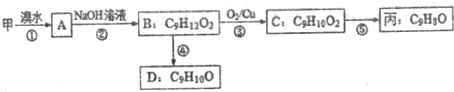
 .
. 、
、 、
、 (其中一种).
(其中一种).