题目内容
4.(1)请写出下列物质的结构简式:①2-甲基-3-乙基戊烷:
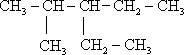 ;
;②2,3-二甲基-1-丁烯:CH3CH(CH3)C(CH3)=CH2.
(2)请写出下列物质的名称:
①
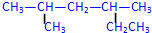 2,4-二甲基己烷
2,4-二甲基己烷②
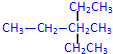 3-甲基-3-乙基戊烷
3-甲基-3-乙基戊烷(3)在有机反应中,反应条件尤为重要.条件(如温度、溶剂、催化剂等)改变,反应产物可能会随之改变.
①已知苯与浓硝酸、浓硫酸的混合物在50-60℃反应时生成硝基苯;若反应条件升温至100-110℃时,反应的化学方程式为
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$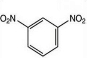 +2H2O.
+2H2O.②卤代烃与碱反应时,溶剂不同则产物不同.若溴乙烷与氢氧化钾的水溶液反应,反应的化学方程式为:CH3CH2Br+KOH $→_{△}^{H_{2}O}$CH3CH2OH+KBr.
③甲苯能与溴蒸汽在光照条件下发生反应生成一溴代物,反应的化学方程式为:CH3-C6H5+Br2$\stackrel{光照}{→}$Br-CH2-C6H5+HBr.
(4)某有机分子结构如下:
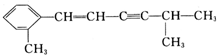 该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
该分子中至少有8个C原子在同一平面,最多有13个C原子在同一平面.
分析 (1)①最长碳链为5,分别在2、3号碳上含有1个甲基和乙基,据此书写结构简式;
②该有机物为烯烃,根据烯烃的系统命名法形成其结构简式;
(2)①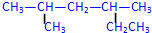 最长碳链为6,为饱和烷烃,在2、4号碳上分别含有1个甲基;
最长碳链为6,为饱和烷烃,在2、4号碳上分别含有1个甲基;
②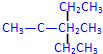 最长碳链为5,为饱和烷烃,在3号碳上分别含有1个甲基和乙基;
最长碳链为5,为饱和烷烃,在3号碳上分别含有1个甲基和乙基;
(3)①苯与浓硝酸、浓硫酸的混合物升温至100-110℃时,发生二元取代,生成间二硝基苯;
②氯代烃与碱性水溶液发生取代反应;
③甲苯与溴蒸汽在光照条件下发生取代反应,取代的位置为甲基上的氢原子;
(4)苯环、碳碳双键为平面结构,碳碳三键为直线结构,以此分析即可.
解答 解:(1)①2-甲基-3-乙基戊烷的最长碳链为5,在2号碳上含有1个甲基,在3号碳上含有1个乙基,故结构简式为: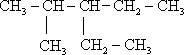 ,
,
故答案为: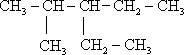 ;
;
②2,3-二甲基-1-丁烯,主链是丁烯,碳碳双键在1号碳原子上,从碳碳双键最近一端编号,2、3号碳原子上各有1个甲基,结构简式:CH3CH(CH3)C(CH3)=CH2,
故答案为:CH3CH(CH3)C(CH3)=CH2;
(2)①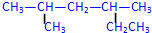 最长碳链为6,为饱和烷烃,称为己烷,在2、4号碳上分别含有1个甲基,正确命名为:2,4-二甲基己烷,
最长碳链为6,为饱和烷烃,称为己烷,在2、4号碳上分别含有1个甲基,正确命名为:2,4-二甲基己烷,
故答案为:2,4-二甲基己烷;
② 最长碳链为5,为饱和烷烃,在3号碳上分别含有1个甲基和乙基,正确命名为:3-甲基-3-乙基戊烷,故答案为:3-甲基-3-乙基戊烷;
最长碳链为5,为饱和烷烃,在3号碳上分别含有1个甲基和乙基,正确命名为:3-甲基-3-乙基戊烷,故答案为:3-甲基-3-乙基戊烷;
(3)①苯与浓硝酸、浓硫酸的混合物在100~110℃时发生取代反应生成间-二硝基苯,反应的方程式为 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O,
+2H2O,
故答案为: +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$ +2H2O;
+2H2O;
②溴乙烷在氢氧化钠水溶液中可发生取代反应生成乙醇,方程式为CH3CH2Br+KOH $→_{△}^{H_{2}O}$CH3CH2OH+KBr,故答案为:CH3CH2Br+KOH $→_{△}^{H_{2}O}$CH3CH2OH+KBr;
③甲苯与溴蒸汽在光照条件下反应生成一溴代物化学方程式为:CH3-C6H5+Br2$\stackrel{光照}{→}$Br-CH2-C6H5+HBr,故答案为:CH3-C6H5+Br2$\stackrel{光照}{→}$Br-CH2-C6H5+HBr;
(4)苯是平面形分子,则苯环以及与苯环相连的两个碳原子在同一平面,所以此分子中至少有8个碳原子在同一平面;苯环、碳碳双键为平面结构,碳碳三键为直线结构,则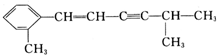 中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH4上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,故答案为:8;13.
中与苯环相连的C、苯环上6个C、碳碳双键中的2个C、碳碳三键中的2个C及CH中的C一定共面,由CH4上的C为四面体构型,可3个原子共面,则2个甲基中由1个C与前面12个C原子共面,即最多13个C原子共面,故答案为:8;13.
点评 本题主要考查有机物的命名与结构简式书写、有机反应化学方程式的书写,明确化学反应的原理是解题的关键,难度不大.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| 有机物 | 加入试剂 | 预期现象 |
| (1)甲苯 | 酸性高锰酸钾 | |
| (2)苯乙烯 | 溴水 | |
| (3)苯酚 | 呈紫色 | |
| (4)葡萄糖 | 出现红色沉淀 | |
| (5)淀粉 | 碘水 | |
| (6)鸡蛋清 | 浓硝酸 |
| A. | 三种意见都支持上述反应为氧化还原反应,且电子转移数相同 | |
| B. | 通过闻生成气体气味可判断反应快慢 | |
| C. | 用稀硫酸可鉴别硫代硫酸钠、亚硫酸钠溶液 | |
| D. | 生成的气体可漂白酸性高锰酸钾溶液 |
 ,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
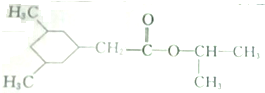 )的线路如下:
)的线路如下:
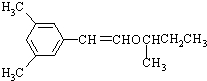 .
. 反应时断裂的化学键是( )
反应时断裂的化学键是( )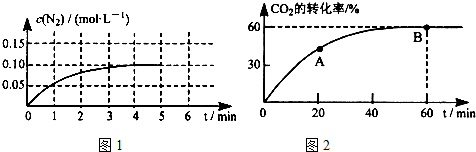
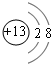 .
.