题目内容
3.已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合.下列关于该晶体的说法不正确的是( )| A. | C3N4晶体是原子晶体 | |
| B. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| C. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
分析 A.根据C3N4晶体结构判断;
B.对相同键型(都是单键/双键/叁键)时,大多数情况下电负性相差越大,键能越大,键长越短.反之电负性相差越小,键能越小,键长越长;
C.每个原子周围要形成8电子稳定结构;
D.根据C3N4晶体结构判断.
解答 解:A.由信息可知,C3N4晶体很可能具有比金刚石还大的硬度,且原子间均以单键结合,所以C3N4为原子晶体,故A正确;
B.N比C电负性大,C-N键比C-C键电负性相差大,键长短,故B正确;
C.因为C的最外层有4个电子,每个电子与另一个N形成C-N(一对共用电子对),因此一个碳原子连接4个N原子,因为N的最外层有5个电子,每个电子与另一个C形成N-C(一对共用电子对),因此一个N原子连接3个C原子,故C正确;
D.C3N4晶体是原子晶体,不存在离子键,故D错误.
故选:D.
点评 本题考查晶体类型的判断,电负性与键长的关系,注意对相同键型(都是单键/双键/叁键)时,大多数情况下电负性相差越大,键能越大,键长越短.反之电负性相差越小,键能越小,键长越长.

练习册系列答案
相关题目
13.下列说法不正确的是( )
| A. | 温度升高,正、逆反应速率都增大 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 氢气和氧气化合生成水和水的电解是可逆反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
14.X、Y、Z是三种主族元素,如果Xm+与Yn-具有相同的电子层结构,Zn-半径大于Yn-半径,则三种元素的原子序数由大到小的顺序是( )
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
11.海洋是一座巨大的化学资源宝库,如图是从海水中提取若干种化学物质的流程图,则下列说法正确的是( )
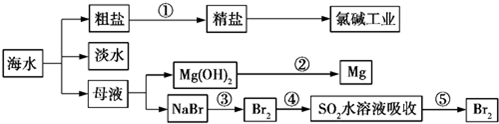

| A. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | ②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段 | |
| C. | ③④⑤中溴元素均被氧化 | |
| D. | 蒸馏法是技术最成熟也是最具发展前景的海水淡化方法 |
18.下列关于价电子构型3s23p4的描述不正确的是( )
| A. | 它的元素符号为S | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 可以与H2化合生成气态化合物 | |
| D. | 其轨道表示式为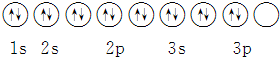 |
8.下列电离方程式或水解方程式中,错误的是( )
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
15.有一种苯的同系物,分子式为C9H12,苯环上只含有一个取代基,则其与氢气完全加成后的产物的一氯代物有(不考虑立体异构)( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
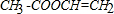 ,B:
,B: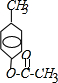 ;
;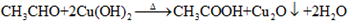 ,
,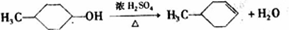 .
.