题目内容
13.下列说法不正确的是( )| A. | 温度升高,正、逆反应速率都增大 | |
| B. | 化学反应的速率和限度均可通过改变化学反应条件而改变 | |
| C. | 氢气和氧气化合生成水和水的电解是可逆反应 | |
| D. | 化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
分析 A.无论吸热反应还是放热反应,升高温度,正逆反应速率都增大;
B.反应速率和反应限度可以通过改变化学反应条件而改变,如温度、浓度等;
C.同一条件下,既能向正反应方向进行同时又能向逆反应方向进行的反应为可逆反应;
D.可逆反应达到平衡状态时,正逆反应速率相等,反应达到动态平衡状态.
解答 解:A.无论吸热反应还是放热反应,升高温度,都知道活化分子百分数,所以正逆反应速率都增大,故A正确;
B.反应速率和反应限度可以通过改变化学反应条件而改变,如温度、浓度等,故B正确;
C.同一条件下,既能向正反应方向进行同时又能向逆反应方向进行的反应为可逆反应,该反应的正逆反应条件不同,所以不是可逆反应,故C错误;
D.可逆反应达到平衡状态时,正逆反应速率相等,反应达到动态平衡状态,反应体系中各物质的物质的量、浓度及百分含量都不变,故D正确;
故选C.
点评 本题考查化学反应速率及平衡影响因素、可逆反应、平衡状态判断等知识点,这些都是高频考点,明确影响反应速率因素中影响原理,易错选项是C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列叙述中正确的是( )
①同周期元素中,ⅦA族元素的原子半径最大
②ⅥA族元素的原子,其半径越大,越容易得到电子
③同一周期中,碱金属元素的第一电离能最小
④当各轨道处于全满、半满、全空时原子较稳定.
①同周期元素中,ⅦA族元素的原子半径最大
②ⅥA族元素的原子,其半径越大,越容易得到电子
③同一周期中,碱金属元素的第一电离能最小
④当各轨道处于全满、半满、全空时原子较稳定.
| A. | ①② | B. | ②④ | C. | ①③ | D. | ③④ |
4.下列反应的离子方程式正确的是( )
| A. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 碳酸氢钙溶液加到盐酸中:Ca(HCO3)2+2HCl=Ca2++2CO2↑+2H2O | |
| C. | 少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ | |
| D. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O |
1.下列说法不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.PM2.5被吸入人体后会直接进入支气管,易引发包括哮喘、支气管炎和心血管病等方面的疾病 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| C. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料 | |
| D. | 生物柴油的主要成分是利用从泔水中提取的地沟油与甲醇反应生成的脂肪酸甲酯类化合物,与石化柴油有本质不同 |
8. 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
①c1合理的数值为D(填字母) A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
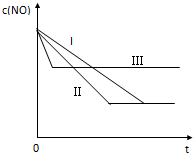
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
则曲线I、Ⅱ、Ⅲ对应的实验编号依次为③②①
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol•L-1 | 10.0 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)10-3mol•L-1 | 3.60 | c2 | 2.75 | 2.70 | 2.70 |
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
| 实验 序号 | T/℃ | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比表面积/㎡•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
3.已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合.下列关于该晶体的说法不正确的是( )
| A. | C3N4晶体是原子晶体 | |
| B. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| C. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
 、
、 .
.