题目内容
14.X、Y、Z是三种主族元素,如果Xm+与Yn-具有相同的电子层结构,Zn-半径大于Yn-半径,则三种元素的原子序数由大到小的顺序是( )| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
分析 Xm+与Yn-具有相同的电子层结构,则X位于Y所在周期相邻的下一周期,Zn-半径大于Yn-半径,Y、Z属于同主族元素,则原子序数Z>Y,据此判断.
解答 解:Xm+与Yn-具有相同的电子层结构,则X位于Y所在周期相邻的下一周期,故原子序数X>Y,Zn-半径大于Yn-半径,Y、Z所带电荷相同属于同主族元素,而且Z在Y的下一周期,则原子序数Z>Y,Z与X同一周期,Z为非金属元素,X为金属元素,则原子序数:Z>X,所以原子序数Z>X>Y,
故选A.
点评 本题考查离子半径大小比较,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.

练习册系列答案
相关题目
4.下列反应的离子方程式正确的是( )
| A. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 碳酸氢钙溶液加到盐酸中:Ca(HCO3)2+2HCl=Ca2++2CO2↑+2H2O | |
| C. | 少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ | |
| D. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O |
9.共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
A.HF B.HCl C.HBr D.H2
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).
19.①丁烷;②2-甲基丙烷;③戊烷;④2-甲基丁烷;⑤2,2-二甲基丙烷.其沸点由高到低排列顺序正确的是( )
| A. | ①②③④⑤ | B. | ⑤④③②① | C. | ③④⑤①② | D. | ②①⑤④③ |
6.某学生做乙醛的还原性实验时,取1mol/LCuSO4溶液和0.5mol/LNaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL40%的乙醛,结果无红色沉淀出现.导致该实验失败的原因可能是( )
| A. | 充分加热至沸腾 | B. | 加入乙醛太少 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
3.已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合.下列关于该晶体的说法不正确的是( )
| A. | C3N4晶体是原子晶体 | |
| B. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| C. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
13.辉铜矿含铜成分高,是最重要的炼铜矿石,其主要成分为Cu2S,还含有Fe2O3、SO2及一些不溶性杂质.以辉铜矿为原料生产碱式碳酸铜的工艺流程如下: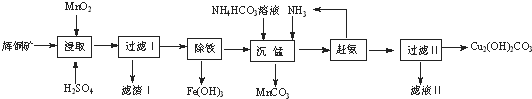
已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生产氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
回答下列问题:
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4,写出浸取时产生CuSO4、MnSO4反应的化学方程式
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;,滤渣Ⅰ的成分为MnSO4、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++CO32-=MnCO3↓.“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度可用滴定法称取6.2500g样品于100mL小烧杯中,加入20mL蒸馏水搅拌,再加入8mL6mol•L-1硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,称取25.00mL配好的溶液于锥形瓶中,加入40.00mL0.2000mol•L-1EDTA溶液,然后计入MnO2,再用0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中Cu2(OH)2CO2的质量分数为78.14%.

已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生产氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4,写出浸取时产生CuSO4、MnSO4反应的化学方程式
2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;,滤渣Ⅰ的成分为MnSO4、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++CO32-=MnCO3↓.“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度可用滴定法称取6.2500g样品于100mL小烧杯中,加入20mL蒸馏水搅拌,再加入8mL6mol•L-1硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,称取25.00mL配好的溶液于锥形瓶中,加入40.00mL0.2000mol•L-1EDTA溶液,然后计入MnO2,再用0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中Cu2(OH)2CO2的质量分数为78.14%.