题目内容
6.通过对模型、图形、图表的观察,获取有关信息是化学学习的一种重要能力.请按要求回答下列问题:
(1)图1是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.
①Y元素在元素周期表中的位置为第二周期第ⅤⅡA族.
②气态氢化物的稳定性:X<(填“>”“<”)Y.
③这五种元素形成的简单离子中,离子半径最大的是S2-(填离子符号).
④Z的氢化物ZH可以和水发生氧化还原反应,其反应方程式为NaH+H2O=NaOH+H2↑.
(2)图2是甲、乙、丙、丁四种物质的转化关系,其中每一步都能一步实现的是B
| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | NO | HNO3 | NO2 | NH3 |
| D | Si | Na2SiO3 | SiO2 | SiF4 |
分析 (1)短周期元素中,X、R的最外层电子数均为6,X的原子序数小,则X为O,R为S,同理可知Y为F,W为Cl,而Z为第三周期元素,最外层电子数为1,即Z为Na;
①Y为F,原子结构中有3个电子层,最外层电子数为7;
②非金属性越强,氢化物越稳定;
③电子层越多,离子半径越大,相同电子排布的离子原子序数大的离子半径小;
④NaH与水反应生成NaOH和氢气;
(2)A.甲到丙,乙到丙,丙到丁都不能一步实现转化;
B.各步都能一步转化;
C.丙到丁不能实现一步转化;
D.乙到丙,丁到甲不能一步转化;
(3)只要通入CO2,立刻就有沉淀BaCO3产生;将Ba(OH)2消耗完毕,接下来消耗NaOH,因而此段不会产生沉淀(即沉淀的量保持不变);NaOH被消耗完毕,接下来又因二氧化碳足量,还可以继续与上面反应的产物Na2CO3、BaCO3、反应,最后剩余沉淀为Al(OH)3.
解答 解:(1)短周期元素中,X、R的最外层电子数均为6,X的原子序数小,则X为O,R为S,同理可知Y为F,W为Cl,而Z为第三周期元素,最外层电子数为1,即Z为Na;
①Y为F,原子结构中有3个电子层,最外层电子数为7,则位于第二周期第ⅤⅡA族,故答案为:第二周期第ⅤⅡA族;
②非金属性Y>X,氢化物的稳定性为X<Y,故答案为:<;
③电子层越多,离子半径越大,相同电子排布的离子原子序数大的离子半径小,这五种元素形成的简单离子中,离子半径最大的是S2-,故答案为:S2-;
④NaH与水反应生成NaOH和氢气,反应为NaH+H2O=NaOH+H2↑,故答案为:NaH+H2O=NaOH+H2↑;
(2)A.甲FeCl3到丙Fe2O3,乙FeCl2到丙Fe2O3,丙Fe2O3到丁Fe(OH)3都不能一步实现转化,故A错误;
B.各步都能一步转化,甲Cu$\stackrel{O_{2}}{→}$乙CuO$\stackrel{H_{2}SO_{4}}{→}$丙CuSO4$\stackrel{BaCl_{2}}{→}$丁CuCl2$\stackrel{Fe}{→}$甲Cu$?_{Fe}^{浓硫酸}$丙CuSO4,故B正确;
C.转化关系中丙NO2→丁NH3,不能一步转化,故C错误;
D.乙Na2SiO3到丙SiO2,丁SiF4到甲Si不能一步转化,故D错误;
故答案为:B;
(3)通入CO2,依次发生:CO2+Ba(OH)2═BaCO3↓+H2O、CO2+2NaOH═Na2CO3+H2O、CO2+3H2O+2NaAlO2═2Al(OH)3↓+Na2CO3、CO2+H2O+Na2CO3═2NaHCO3,BaCO3+CO2+H2O=Ba(HCO3)2,则ab段发生反应的离子方程式为CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32-,故答案为:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32-.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,推断元素、氧化还原反应及离子反应的先后顺序为解答的关键,侧重分析与推断及元素化合物知识的综合考查,题目难度中等.

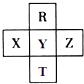 元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )
元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸,生成HR.则下列判断正确的是( )| A. | 非金属性:Z<Y<X | |
| B. | R与Y的电子数相差8 | |
| C. | 气态氢化物稳定性:HR<HY<HT | |
| D. | 最高价氧化物的水化物的酸性:HTO4>HYO4 |
| 事实 | 推测 | |
| A | ${\;}_{12}^{\;}$Mg与水反应缓慢,${\;}_{20}^{\;}$Ca与水反应较快 | ${\;}_{56}^{\;}$Ba(DA族)与水反应会更快 |
| B | 是半导体材料,同族的Ge也是半导体材料 | Ⅳ族的元素都是半导体材料 |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2CO3溶液 | B. | H2SO4溶液 | C. | NaHCO3溶液 | D. | Ba(OH)2溶液 |
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 | |
| D. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
| A. | N | B. | Ni | C. | Cr | D. | Cu+ |
| A. | HCl比H2S稳定 | |
| B. | IA族统称为碱金属,最外层有两个电子的原子一定在IIA 族 | |
| C. | 离子键的本质是带相反电荷的阴、阳离子的相互吸引 | |
| D. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
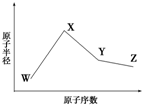 已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体
已知W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X、Y、Z同周期,其中X的M层电子数是K层的一半;Y的单质是一种常见的半导体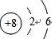 .
.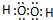 ,化合物XYZ的结构式
,化合物XYZ的结构式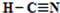 .
.