题目内容
2.如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持设备已省略).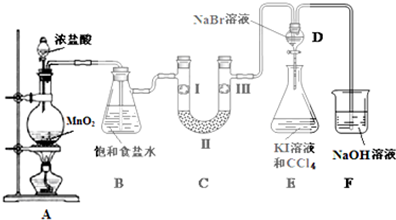
已知:浓硫酸、碱石灰和无水氯化钙均具有吸水性,碱石灰是生石灰和氢氧化钠的混合物.请回答下列问题:
(1)装置A中盛装浓盐酸的仪器名称为分液漏斗,往圆底烧瓶中滴加浓盐酸,反应开始后,圆底烧瓶中发生反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ依次放入d.(填字母)
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
装置D中发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-.
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是装置E中的溶液分为两层,下层(CCl4层)为紫红色.
(6)装置F中NaOH溶液的作用是吸收多余的氯气,防止污染空气.
分析 (1)熟悉仪器的构造和形状说出其名称;二氧化锰与浓盐酸在加热条件下反应生氯气、氯化锰和水;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯化氢和氯气在水中溶解度选择合适的试剂除杂;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)氯气氧化性强于溴,能够置换溴;
(5)溴的氧化性强于碘,溴能够与碘化钾反应生成单质碘,碘单质易溶于四氯化碳,四氯化碳密度大于水;
(6)氯气有毒,直接排放能引起空气污染,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气.
解答 解:(1)装置A中盛装浓盐酸的仪器名称为分液漏斗;二氧化锰与浓盐酸在加热条件下反应生氯气、氯化锰和水,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
故答案为:分液漏斗;4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度很小,所以B中饱和食盐水的作用是:除去Cl2中的HCl;
故答案为:除去Cl2中的HCl;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选d,
故答案为:d;
(4)氯气通入溴化钠溶液反应生成氯化钠和溴单质,离子方程式:2Br-+Cl2=Br2+2Cl-,溴溶液水显橙色;
故答案为:橙;2Br-+Cl2=Br2+2Cl-;
(5)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡;观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;
故答案为:装置E中的溶液分为两层,下层(CCl4层)为紫红色;
(6)氯气有毒,直接排放能引起空气污染,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:吸收多余的氯气,防止污染空气.
点评 本题考查了氯气实验室制取、氯气化学性质、实验设计、实验装置的理解评价、化学方程式的书写等,把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键,题目难度中等.

| A. | 将人群转移到地势较低的地方,等待营救 | |
| B. | 人群顺风逃跑 | |
| C. | 用高压水枪向空中喷洒大量碱性溶液 | |
| D. | 被转移人群可戴上用NaOH处理过的口罩 |
| A. | 无色溶液中:Na+、Cu2+、Cl- | |
| B. | 能与金属铝反应放出氢气的溶液中:K+、CO32-、NH4+ | |
| C. | 能使酚酞试液变红的溶液中:Na+、Cl-、SO42- | |
| D. | 含有大量H+的溶液中:Na+、Cl-、OH- |
| A. | 铅为负极被还原 | B. | 电解质溶液密度不断减小 | ||
| C. | SO42-只向PbO2极移动 | D. | 溶液的pH不断减小 |
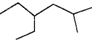 ,这种炔烃有( )
,这种炔烃有( )| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
| A. | Na2O2用作呼吸面具的供氧剂 | B. | NaHCO3的热稳定性大于Na2CO3 | ||
| C. | 乙醇可与金属钠反应放出氢气 | D. | 金属钠着火时,用细沙覆盖灭火 |
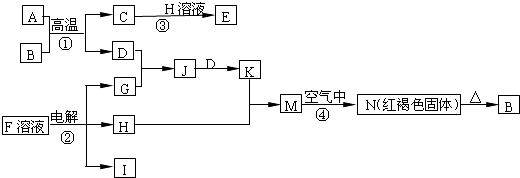
 .
.